题目
解释下列名词:同离子效应,盐效应,共沉淀现象,后沉淀现象,再沉淀,陈化,均匀沉淀法。(1)反应的完全程度高,达到平衡的速率快,不易形成过饱和溶液,即 反应能定量进行。(2)沉淀的组成恒定,沉淀的溶解度必须很小,在沉淀的过程中不易发生共沉淀现象。(3)有确定终点的简便方法。14.什么叫后沉淀?消除后沉淀有哪些方法?答:在一定条件下,当某沉淀析出后,沉淀与母液一起放置,溶液中本不能析出沉淀的组分,也在该沉淀表面逐渐沉积出来的现象。消除后沉淀的方法是缩短沉淀和母液共置的时间。15.什么叫银量法?莫尔法?佛尔哈德法?及扬司法?答:a、银量法(argentimetry):以银盐沉淀反应为基础的沉淀滴定方法。b、铬酸钾指示剂法(莫尔法、Mohr法):以铬酸钾(K2CrO4)为指示剂的银量法。c、铁铵钒指示剂法(佛尔哈德法、Volhard法):以铁铵矾(NH4Fe(SO4)2·12H2O)为指示剂的银量法。本法分为直接滴定法和返滴定法。d、吸附指示剂法(法扬司法、Fajans法):以吸附剂为指示剂的银量法。16.写出莫尔法、佛尔哈德法和法扬斯法测定Cl-的主要反应,并指出各种方法选用的指示剂和酸度条件。答:(1)莫尔法主要反应: Cl-+Ag+=AgCl↓指示剂:铬酸钾酸度条件:pH=6.0∽10.5(2)佛尔哈德法主要反应:Cl-+Ag+(过量)=AgCl↓、Ag+(剩余)+SCN-=AgSCN↓ 指示剂:铁铵矾。酸度条件:0.1∽1 mol/L(3)法扬斯法主要反应:Cl-+Ag+=AgCl↓指示剂:荧光黄酸度条件:pH=7∽10.517.简要说明莫尔法测定Cl-的原理?答: 用AgNO3为滴定剂,K2CrO4为指示剂,因为s(AgCl)<18.能否用莫尔法直接滴定Ag+? 为什么?答:不能,因为加入指示剂后即生成Ag2CrO4砖红色沉淀。Ag2CrO4 沉淀全部转为AgCl,反应较慢,无法确定终点。19.用银量法测定下列试样:(1)BaCl2,(2)KCl,(3)NH4Cl,(4)KSCN,(5)NaCO3+NaCl,(6)NaBr,各应选用何种方法确定终点?为什么?答:(1)BaCl2用佛尔哈德法或法扬斯法。因为莫尔法能生成BaCrO4沉淀。(2)Cl-用莫尔法。此法最简便。(3)NH4Cl用佛尔哈德法或法扬斯法。因为当、[NH4+]大了不能用莫尔法测定,即使[NH4+]不大酸度也难以控制。(4)SCN-用佛尔哈德法最简便。(5)NaCO3+NaCl用佛尔哈德法。如用莫尔法、法扬斯法时生成Ag2CO3沉淀造成误差。(6)NaBr 用佛尔哈德法最好。用莫尔法在终点时必须剧烈摇动,以减少AgBr吸附Br-而使终点过早出现。用法扬斯法必须采用曙红作指示剂。20.在下列情况下,测定结果是偏高、偏低,还是无影响?并说明其原因。(1)在pH=4的条件下,用莫尔法测定Cl-;(2) 用佛尔哈德法测定Cl-既没有将AgCl沉淀滤去或加热促其凝聚,有没有加有机溶剂;(3) 同(2)的条件下测定Br-;(4)用法扬斯法测定Cl-,曙红作指示剂;(5)用法扬斯法测定I-,曙红作指示剂。答:(1)偏高。因部分CrO42- 转变成Cr2O72-,指示剂剂浓度降低,则终点推迟出现。(2)偏低。因有部分AgCl转化成AgSCN沉淀,返滴定时,多消耗硫氰酸盐标准溶液。(3)无影响。因AgBr的溶解度小于AgSCN,则不会发生沉淀的转化作用。(4)偏低。因AgCl强烈吸附曙红指示剂,使终点过早出现。(5)无影响。因AgI吸附I-的能力较曙红阴离子强,只有当[I-]降低到终点时才吸附曙红阴离子而改变颜色。21.用过量Ba2+沉淀SO4-2时,试液中含有少量NO3-、Ac-、K+、Mg2+、Fe3+等杂质。当沉淀完全后,扩散层中优先吸附的杂质离子是什么?为什么?答:这是因为 沉淀表面存在大量Ba2+,NO3-与Ba2+形成的Ba(NO3)2的溶解度最小,所以吸附层中优先吸附的杂质离子是NO3-。22.什么是均匀沉淀?均匀沉淀法有哪些优点?试举两实例说明之(用反应式表明沉淀过程)。答:利用化学反应使溶液中缓慢而均匀地产生沉淀剂,待沉淀剂达到一定浓度时,产生颗粒大,结构紧密、纯净而易过滤和洗涤的沉淀的沉淀方式叫均匀沉淀。优点:得到的沉淀颗粒大,表面吸附杂质少,易过滤洗涤例1:硫代乙酰胺水解生成H2S,沉淀硫化物 CH3CSNH2+H2O====CH3CONH2+H2S M2++S2-====MS↓例2:尿素水解生成NH3,中和溶液中的H+,使CaC2O4均匀沉淀 CO(NH2)2+H2O====CO2+2NH3 Ca2++C2O42-+H+====CaC2O4↓H+ + NH3====NH4+23. 简述四中滴定方法(酸碱、配位、沉淀及氧化还原滴定)的异同点?答:共同之处:a.都以消耗(CV)标准物来测定被测物质含量。b.随着滴定剂加入,被测物在计量点P附近有突变(突跃),利用这一突变导致指示剂变色来指示滴定终点不同之处 : a.强酸(碱)的滴定产物是H2O,从滴定开始至结束 [H2O]=55.5mol/L为一常数; b.沉淀滴定有异相产生,一旦沉淀产生,它的 活度就被指定为1,且不再改变; c.配位滴定产物MY一旦生成,其浓度一直在近线性地增大,直达计量点;d.氧化还原产物最简单,且产物有两种,浓度一直在变,直达计量点。24.为了使沉淀定量完全,必须加人过量沉淀剂,为什么又不能过量太多? 答:在重量分析法中,为使沉淀完全,常加入过量的沉淀剂,这样可以利用共同离子效应来降低沉淀的溶解度。沉淀剂过量的程度,应根据沉淀剂的性质来确定。若沉淀剂不易挥发,应过量20%~50%;若沉淀剂易挥发,则可过量多些,甚至过量100%。但沉淀剂不能过量太多,否则可能发生盐效应、配位效应等,反而使沉淀的溶解度增大。25.要获得纯净而易于分离和洗涤的晶形沉淀,需采取些什么措施?为什么?答:欲得到晶形沉淀应采取以下措施: (1)在适当稀的溶液中进行沉淀,以降低相对过饱和度。 (2)在不断搅拌下慢慢地加入稀的沉淀剂,以免局部相对过饱和度太大。 (3)在热溶液中进行沉淀,使溶解度略有增加,相对过饱和度降低。同时,温度升高,可减少杂质的吸附。 (4)陈化。陈化就是在沉淀完全后将沉淀和母液一起放置一段时间。在陈化过程中,小晶体逐渐溶解,大晶体不断长大,最后获得粗大的晶体。同时,陈化还可以使不完整的晶粒转化为较完整的晶粒,亚稳定的沉淀转化为稳定态的沉淀。也能使沉淀变得更纯净。26.试讨论摩尔法的局限性。答:摩尔法只能在中性或弱减性(pH 6.5~10.5)溶液中进行,因为在酸性溶液中CrO42-浓度降低,影响Ag2CrO4沉淀形成,终点过迟。在强碱性溶液中,AgNO3会生成Ag2O沉淀。此外,摩尔法只能用来测定Cl-、Br-等,却不能用NaCl直接滴定Ag+ .27.为了使终点颜色变化明显,使用吸附指示剂应注意哪些问题?答:(1)由于吸附指示剂的颜色变化发生在沉淀微粒表面上,因此应尽可能使卤化银沉淀呈胶体状态,具有较大的表面积。(2)常用的吸附指示剂大多是有机弱酸,而起指示作用的是他们的阴离子,因此在使用吸附指示剂时,要注意调节溶液pH值。(3)卤化银沉淀对光敏感,遇光易分解析出金属银,使沉淀很快转变为灰黑色,影响终点观察,因此在滴定过程中应避免强光照射。(4)胶体微粒对指示剂离子的吸附能力,应略小于对待测离子的吸附能力,否则指示剂将在化学计量点前变色,但如果吸附能力太差,终点时变色也不敏锐。(5)溶液中被滴定离子的浓度不能太低,因为浓度太低时沉淀很少,观察终点比较困难。28.为了测定大理石中的CaCO3的含量,能否直接用标准HCl溶液滴定?你认为正确的操作应如何进行?答:不能。 正确的操作是:采用返滴定法,即先加入一定量且过量的HCl标准溶液,待其与CaCO3反应完全后,再用NaOH标准溶液滴定剩余的HCl标准溶液,从而计算被测物质CaCO3的含量。29.试简述KMnO4标准溶液的配制方法。
解释下列名词:同离子效应,盐效应,共沉淀现象,后沉淀现象,再沉淀,陈化,均匀沉淀法。


(1)反应的完全程度高,达到平衡的速率快,不易形成过饱和溶液,即 反应能定量进行。
(2)沉淀的组成恒定,沉淀的溶解度必须很小,在沉淀的过程中不易发生共沉淀现象。
(3)有确定终点的简便方法。
14.什么叫后沉淀?消除后沉淀有哪些方法?
答:在一定条件下,当某沉淀析出后,沉淀与母液一起放置,溶液中本不能析出沉淀的组分,也在该沉淀表面逐渐沉积出来的现象。消除后沉淀的方法是缩短沉淀和母液共置的时间。
15.什么叫银量法?莫尔法?佛尔哈德法?及扬司法?
答:a、银量法(argentimetry):以银盐沉淀反应为基础的沉淀滴定方法。
b、铬酸钾指示剂法(莫尔法、Mohr法):以铬酸钾(K2CrO4)为指示剂的银量法。
c、铁铵钒指示剂法(佛尔哈德法、Volhard法):以铁铵矾(NH4Fe(SO4)2·12H2O)为指示剂的银量法。本法分为直接滴定法和返滴定法。
d、吸附指示剂法(法扬司法、Fajans法):以吸附剂为指示剂的银量法。
16.写出莫尔法、佛尔哈德法和法扬斯法测定Cl-的主要反应,并指出各种方法选用的指示剂和酸度条件。
答:(1)莫尔法
主要反应: Cl-+Ag+=AgCl↓
指示剂:铬酸钾
酸度条件:pH=6.0∽10.5
(2)佛尔哈德法
主要反应:Cl-+Ag+(过量)=AgCl↓、Ag+(剩余)+SCN-=AgSCN↓ 指示剂:铁铵矾。
酸度条件:0.1∽1 mol/L
(3)法扬斯法
主要反应:Cl-+Ag+=AgCl↓
指示剂:荧光黄
酸度条件:pH=7∽10.5
17.简要说明莫尔法测定Cl-的原理?
答: 用AgNO3为滴定剂,K2CrO4为指示剂,因为s(AgCl)<
18.能否用莫尔法直接滴定Ag+? 为什么?
答:不能,因为加入指示剂后即生成Ag2CrO4砖红色沉淀。Ag2CrO4 沉淀全部转为AgCl,反应较慢,无法确定终点。
19.用银量法测定下列试样:(1)BaCl2,(2)KCl,(3)NH4Cl,(4)KSCN,
(5)NaCO3+NaCl,(6)NaBr,各应选用何种方法确定终点?为什么?
答:(1)BaCl2用佛尔哈德法或法扬斯法。因为莫尔法能生成BaCrO4沉淀。
(2)Cl-用莫尔法。此法最简便。
(3)NH4Cl用佛尔哈德法或法扬斯法。因为当、[NH4+]大了不能用莫尔法测定,即使[NH4+]不大酸度也难以控制。
(4)SCN-用佛尔哈德法最简便。
(5)NaCO3+NaCl用佛尔哈德法。如用莫尔法、法扬斯法时生成Ag2CO3沉淀造成误差。
(6)NaBr 用佛尔哈德法最好。用莫尔法在终点时必须剧烈摇动,以减少AgBr吸附Br-而使终点过早出现。用法扬斯法必须采用曙红作指示剂。
20.在下列情况下,测定结果是偏高、偏低,还是无影响?并说明其原因。
(1)在pH=4的条件下,用莫尔法测定Cl-;
(2) 用佛尔哈德法测定Cl-既没有将AgCl沉淀滤去或加热促其凝聚,有没有加有机溶剂;
(3) 同(2)的条件下测定Br-;
(4)用法扬斯法测定Cl-,曙红作指示剂;
(5)用法扬斯法测定I-,曙红作指示剂。
答:
(1)偏高。因部分CrO42- 转变成Cr2O72-,指示剂剂浓度降低,则终点推迟出现。
(2)偏低。因有部分AgCl转化成AgSCN沉淀,返滴定时,多消耗硫氰酸盐标准溶液。
(3)无影响。因AgBr的溶解度小于AgSCN,则不会发生沉淀的转化作用。
(4)偏低。因AgCl强烈吸附曙红指示剂,使终点过早出现。
(5)无影响。因AgI吸附I-的能力较曙红阴离子强,只有当[I-]降低到终点时才吸附曙红阴离子而改变颜色。
21.用过量Ba2+沉淀SO4-2时,试液中含有少量NO3-、Ac-、K+、Mg2+、Fe3+等杂质。当沉淀完全后,扩散层中优先吸附的杂质离子是什么?为什么?答:这是因为 沉淀表面存在大量Ba2+,NO3-与Ba2+形成的Ba(NO3)2的溶解度最小,所以吸附层中优先吸附的杂质离子是NO3-。
22.什么是均匀沉淀?均匀沉淀法有哪些优点?试举两实例说明之(用反应式表明沉淀过程)。
答:利用化学反应使溶液中缓慢而均匀地产生沉淀剂,待沉淀剂达到一定浓度时,产生颗粒大,结构紧密、纯净而易过滤和洗涤的沉淀的沉淀方式叫均匀沉淀。
优点:得到的沉淀颗粒大,表面吸附杂质少,易过滤洗涤
例1:硫代乙酰胺水解生成H2S,沉淀硫化物 CH3CSNH2+H2O====CH3CONH2+H2S M2++S2-====MS↓
例2:尿素水解生成NH3,中和溶液中的H+,使CaC2O4均匀沉淀 CO(NH2)2+H2O====CO2+2NH3 Ca2++C2O42-+H+====CaC2O4↓
H+ + NH3====NH4+
23. 简述四中滴定方法(酸碱、配位、沉淀及氧化还原滴定)的异同点?答:共同之处:
a.都以消耗(CV)标准物来测定被测物质含量。
b.随着滴定剂加入,被测物在计量点P附近有突变(突跃),利用这一突变导致指示剂变色来指示滴定终点
不同之处 : a.强酸(碱)的滴定产物是H2O,从滴定开始至结束 [H2O]=55.5mol/L为一常数; b.沉淀滴定有异相产生,一旦沉淀产生,它的 活度就被指定为1,且不再改变; c.配位滴定产物MY一旦生成,其浓度一直在近线性地增大,直达计量点;d.氧化还原产物最简单,且产物有两种,浓度一直在变,直达计量点。
24.为了使沉淀定量完全,必须加人过量沉淀剂,为什么又不能过量太多? 答:在重量分析法中,为使沉淀完全,常加入过量的沉淀剂,这样可以利用共同离子效应来降低沉淀的溶解度。沉淀剂过量的程度,应根据沉淀剂的性质来确定。若沉淀剂不易挥发,应过量20%~50%;若沉淀剂易挥发,则可过量多些,甚至过量100%。但沉淀剂不能过量太多,否则可能发生盐效应、配位效应等,反而使沉淀的溶解度增大。
25.要获得纯净而易于分离和洗涤的晶形沉淀,需采取些什么措施?为什么?
答:欲得到晶形沉淀应采取以下措施: (1)在适当稀的溶液中进行沉淀,以降低相对过饱和度。 (2)在不断搅拌下慢慢地加入稀的沉淀剂,以免局部相对过饱和度太大。 (3)在热溶液中进行沉淀,使溶解度略有增加,相对过饱和度降低。同时,温度升高,可减少杂质的吸附。 (4)陈化。陈化就是在沉淀完全后将沉淀和母液一起放置一段时间。在陈化过程中,小晶体逐渐溶解,大晶体不断长大,最后获得粗大的晶体。同时,陈化还可以使不完整的晶粒转化为较完整的晶粒,亚稳定的沉淀转化为稳定态的沉淀。也能使沉淀变得更纯净。
26.试讨论摩尔法的局限性。
答:摩尔法只能在中性或弱减性(pH 6.5~10.5)溶液中进行,因为在酸性溶液中CrO42-浓度降低,影响Ag2CrO4沉淀形成,终点过迟。在强碱性溶液中,AgNO3会生成Ag2O沉淀。此外,摩尔法只能用来测定Cl-、Br-等,却不能用NaCl直接滴定Ag+ .
27.为了使终点颜色变化明显,使用吸附指示剂应注意哪些问题?
答:(1)由于吸附指示剂的颜色变化发生在沉淀微粒表面上,因此应尽可能使卤化银沉淀呈胶体状态,具有较大的表面积。(2)常用的吸附指示剂大多是有机弱酸,而起指示作用的是他们的阴离子,因此在使用吸附指示剂时,要注意调节溶液pH值。(3)卤化银沉淀对光敏感,遇光易分解析出金属银,使沉淀很快转变为灰黑色,影响终点观察,因此在滴定过程中应避免强光照射。(4)胶体微粒对指示剂离子的吸附能力,应略小于对待测离子的吸附能力,否则指示剂将在化学计量点前变色,但如果吸附能力太差,终点时变色也不敏锐。(5)溶液中被滴定离子的浓度不能太低,因为浓度太低时沉淀很少,观察终点比较困难。
28.为了测定大理石中的CaCO3的含量,能否直接用标准HCl溶液滴定?你认为正确的操作应如何进行?
答:不能。 正确的操作是:采用返滴定法,即先加入一定量且过量的HCl标准溶液,待其与CaCO3反应完全后,再用NaOH标准溶液滴定剩余的HCl标准溶液,从而计算被测物质CaCO3的含量。
29.试简述KMnO4标准溶液的配制方法。
题目解答
答案
解:(1)称取稍多于理论量的KMnO4,溶解于蒸馏水中;
(2)将配好的溶液加热至沸,保持微沸1小时,放置2~3天;
(3)用微孔玻璃漏斗过滤,除去析出的沉淀;
(4)将过滤后的溶液贮存于棕色试剂瓶中,存放于暗处,以待标定。
30. 滴定分析法包括哪几种方法?滴定方式包括哪几种方式?
解:(1)酸碱滴定法,络合滴定法,氧化还原滴定法,沉淀滴定法
(2)直接滴定,间接滴定,返滴定,置换滴定
31. 基准物质应具备哪些条件?
答:① 必须具有足够的纯度,一般要求其纯度在99.9%以上.
② 物质的组成与化学式完全相符,若含结晶水,则结晶水的含量也必须与化学式相符;
③ 性质稳定,在配制和贮存时不会发生变化。比如,在烘干时不易分解,称量时不易吸湿,不吸收空气中的二氧化碳,也不易变质等; ④ 最好具有较大的摩尔质量。
32. 什么叫沉淀滴定法,沉淀滴定法所用的沉淀反应必须具备哪些条件?
沉淀滴定法是以沉淀反应为基础的一种滴定分析方法。
沉淀滴定法必须满足的条件:1. 沉淀的溶解度小,且能定量完成;2.反应速度大;3.有适当指示剂指示终点;4.吸附现象不影响终点观察。
33.解释银量法、铬酸钾指示剂法(莫尔法、Mohr法)、铁铵钒指示剂法(佛尔哈德法、Volhard法)
银量法(argentimetry):以银盐沉淀反应为基础的沉淀滴定方法。
铬酸钾指示剂法(莫尔法、Mohr法):以铬酸钾(K2CrO4)为指示剂的银量法。
铁铵钒指示剂法(佛尔哈德法、Volhard法):以铁铵矾(NH4Fe(SO4)2·12H2O)为指示剂的银量法。本法分为直接滴定法和返滴定法。
34.后沉淀、均匀沉淀的定义
后沉淀:在一定条件下,当某沉淀析出后,沉淀与母液一起放置,溶液中本不能析出沉淀的组分,也在该沉淀表面逐渐沉积出来的现象。消除后沉淀的方法是缩短沉淀和母液共置的时间。
均匀沉淀:利用化学反应使溶液中缓慢而均匀地产生沉淀剂,待沉淀剂达到一定浓度时,产生颗粒大,结构紧密、纯净而易过滤和洗涤的沉淀。
35.写出莫尔法测定Cl-的主要反应,并指出各种方法选用的指示剂和酸度条件。
解:莫尔法
主要反应:Cl-+Ag+=AgCl↓ 2Ag+ + CrO42+ = Ag2CrO4↓(砖红色)
指示剂:铬酸钾[K2CrO4] 酸度条件:pH=6.0~10.5
36.解释什么是吸附共沉淀
吸附共沉淀(adsorption coprecipitation):由于沉淀表面吸附引起的共沉淀。沉淀颗粒愈小,表面积愈大,吸附溶液中异电荷离子的能力越强。减少或消除吸附共沉淀的有效方法是洗涤沉淀。
37.均匀沉淀法有哪些优点?试举两实例说明之(用反应式表明沉淀过程)。
均匀沉淀法得到的沉淀颗粒大,表面吸附杂质少,易过滤洗涤
例1:硫代乙酰胺水解生成H2S,沉淀硫化物
△
CH3CSNH2+H2O====CH3CONH2+H2S
M2++S2-====MS↓
例2:尿素水解生成NH3,中和溶液中的H+,使CaC2O4均匀沉淀
△
CO(NH2)2+H2O====CO2+2NH3
Ca2++C2O42-+H+====CaC2O4↓
H+ + NH3====NH4+
38. 能否用莫尔法直接滴定Ag+? 为什么?
答: 不能,因为加入指示剂后即生成Ag2CrO4砖红色沉淀。Ag2CrO4 沉淀全部转为AgCl,反应较慢,无法确定终点。
39.写出佛尔哈德法测定Cl-的主要反应,并指出各种方法选用的指示剂和酸度条件。
佛尔哈德法主要反应:Cl-+Ag+(过量)=AgCl↓
Ag+(剩余)+SCN-=AgSCN↓
Fe3+ + SCN- = FeSCN2+(红色)
指示剂:铁铵矾[NH4Fe(SO4)2] 酸度条件:酸性(0.1~1mol.L-1)。
40.解释吸附指示剂法(法扬司法、Fajans法)、重量分析法(gravimetric analysis method)、沉淀法(precipitation method)
吸附指示剂法 :以吸附剂为指示剂的银量法。
重量分析法 :通过称量物质的某种称量形式质量来确定被测组分含量的定量分析方法。
沉淀法 :利用沉淀反应使待测组分以难溶化合物的形式沉淀出来,通过称量物质沉淀的称量形式质量来确定被测组分含量的定量分析方法。
41.简述滴定度的概念。
答:滴定度有两种表示方法: (1) 指每毫升滴定液中所含溶质的质量(g/ml),以TB表示。mB=TB·V;
(2) 指每毫升滴定液相当于被测物质的质量(g/ml),以TB/A表示。mA=TB/A·V。
42.解释挥发法、萃取法
挥发法 :利用被测组分的挥发性或可转化为挥发性物质的性质,进行含量测定的方法。挥发法又分为直接法和间接法。
萃取法 : 利用被测组分与其他组分在互不混溶的两种溶剂中分配比不同,使被测组分从试样中定量转移至提取剂中而与其他组分分离,进行含量测定的方法。
43.若用莫尔法测定Ag+,应如何进行?
答:用莫尔法测定Ag+,首先加入过量的NaCl标准溶液,然后用AgNO3标准溶液滴定剩余的Cl-,即可测得Ag+的含量。但不能用NaCl直接滴定Ag+,因为莫尔法是用K2CrO4作指示剂,加入指示剂后,
Ag+ + CrO42-Ag2CrO4滴定过程中Ag2CrO4AgCl速度很慢,颜色变化不敏锐。
44.解释什么是固有溶解度或分子溶解度、沉淀形式(precipitation form)、称量形式(weighing form)
固有溶解度(intrinsic solubility)或分子溶解度:在一定温度下,纯固体活度 ,
,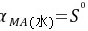 。即在一定温度下,固相与其液相共存时,溶液中以分子(或离子对)状态存在的活度。
。即在一定温度下,固相与其液相共存时,溶液中以分子(或离子对)状态存在的活度。
 ,
,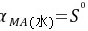 。即在一定温度下,固相与其液相共存时,溶液中以分子(或离子对)状态存在的活度。
。即在一定温度下,固相与其液相共存时,溶液中以分子(或离子对)状态存在的活度。沉淀形式(precipitation form):沉淀重量法中,形成沉淀的化学组成。
称量形式(weighing form):沉淀形式经处理后供最后称量的化学组成。
45.请阐述以下效应:
(1)酸效应(acid effect)
(2)配位效应(complex effect)
(3)盐效应(salt effect)
酸效应(acid effect):当沉淀反应达到平衡后,增加溶液的酸度可使沉淀溶解度增大的现象。
配位效应(complex effect):当溶液中存在能与金属离子生成可溶性配合物的配位剂时,可使沉淀溶解度增大的现象。
盐效应(salt effect):沉淀溶解度随溶液中离子强度的增加而增大的现象。
46.均相成核、异相成核各是怎么样一个过程
均相成核:在过饱和溶液中,构晶离子由于静电作用而缔合,从溶液中自发地产生晶核的过程。溶液的相对过饱和度愈大,均相成核的数目愈多。
异相成核:在沉淀的介质和容器中不可避免存在有一些固体微粒,构晶离子或离子群扩散到这些微粒表面,诱导构晶离子形成晶核的过程。固体微粒越多,异相成核数目愈多
47.写出法扬斯法测定Cl-的主要反应,并指出各种方法选用的指示剂和酸度条件。
法扬司法
主要反应:Cl-+Ag+=AgCl↓ AgCl.Ag+ + FIn- = AgCl.Ag+.FIn-(粉红色)
指示剂:荧光黄 酸度条件:pH=7~10.5
48.什么是无定型沉淀、晶型沉淀
无定型沉淀:颗粒直径小于0.02μm的沉淀。形成沉淀时,相对过饱和度越大,聚集速度越快,形成无定型沉淀。
晶型沉淀:颗粒直径在0.1~1μm的沉淀。形成沉淀时,相对过饱和度越小,聚集速度越慢,定向速度越快,形成晶型沉淀。
49.简要说明莫尔法测定Cl-的原理。
答: 用AgNO3为滴定剂,K2CrO4为指示剂,因为s(AgCl)<
50.条件溶度积的定义
条件溶度积:在一定条件下,由于副反应的存在,使沉淀溶解度增大,用条件溶度积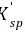 表示。
表示。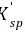 >Ksp,同一种沉淀的
>Ksp,同一种沉淀的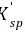 随沉淀条件的变化而改变。
随沉淀条件的变化而改变。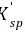 能真实、客观地反映沉淀的溶解度及其影响因素。
能真实、客观地反映沉淀的溶解度及其影响因素。
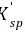 表示。
表示。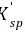 >Ksp,同一种沉淀的
>Ksp,同一种沉淀的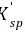 随沉淀条件的变化而改变。
随沉淀条件的变化而改变。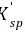 能真实、客观地反映沉淀的溶解度及其影响因素。
能真实、客观地反映沉淀的溶解度及其影响因素。51.解释同离子效应
同离子效应 :当沉淀反应达到平衡后,增加适量构晶离子的强电解质浓度,可使沉淀溶解度降低的现象。在重量分析中,常加入过量的沉淀剂,利用同离子效应使沉淀完全。
52.沉淀滴定法中银量法的定义及原理
银量法是以硝酸银液为滴定液,测定能与Ag+反应生成难溶性沉淀的一种容量分析法。
银量法原理:以硝酸银液为滴定液,测定能与Ag+生成沉淀的物质,根据消耗滴定液的浓度和毫升数,可计算出被测物质的含量。
53.欲用莫尔法测定BaCl22H2O中的Cl-,如何消除Ba2+的干扰?
答:可加入Na2CO3或Na2SO4将Ba2+沉淀下来,通常不用H2SO4来沉淀Ba2+,因为莫尔法在中性弱碱性介质中进行,若一定用H2SO4,则需加入NaHCO3调节pH后,再进行滴定。
54.解释什么是混晶共沉淀
混晶共沉淀 :由于被吸附的杂质与沉淀具有相同的晶格或相同的电荷和离子半径,杂质离子可进入晶格排列引起的共沉淀。减少或消除混晶共沉淀的方法是在沉淀时加入沉淀剂的速度慢,沉淀进行陈化。
55.在下列情况下,测定结果是偏高、偏低,还是无影响?并说明其原因。 (1) 在pH=4的条件下,用莫尔法测定Cl-; (2) 用佛尔哈德法测定Cl-,既没有将AgCl沉淀滤去或加热促其凝聚,又没有加有机溶剂; (3) 同(2)的条件下测定Br-; (4) 用法扬斯法测定Cl-,曙红作指示剂; (5) 用法扬斯法测定I-,曙红作指示剂。
答:(1)偏高。因部分CrO42- 转变成Cr2O72-,指示剂浓度降低,则终点推迟出现。
(2)偏低。因有部分AgCl转化成AgSCN沉淀,返滴定时,多消耗硫氰酸盐标准溶液。
(3)无影响。因AgBr的溶解度小于AgSCN,则不会发生沉淀的转化作用。
(4)偏低。因AgCl强烈吸附曙红指示剂,使终点过早出现。
(5)无影响。因AgI吸附I-的能力较曙红阴离子强,只有当[I-]降低到终点时才吸附曙红阴离子而改变颜色。
56.阐述铬酸钾指示剂法的原理及反应过程
铬酸钾指示剂法的原理是用AgNO3滴定液滴定氯化物、溴化物时采用铬酸钾作指示剂的滴定方法。
滴定反应为:终点前Ag++Cl-→AgCl↓
终点时2Ag++CrO42-→Ag2CrO4↓(砖红色)
根据分步沉淀的原理,溶度积(Ksp)小的先沉淀,溶度积大的后沉淀。由于AgCl的溶解度小于Ag2CrO4的溶解度,当Ag+进入浓度较大的Cl-溶液中时,AgCl将首先生成沉淀,而[Ag+]2[CrO42-]Ksp,于是出现砖红色沉淀,指示滴定终点的到达。
57.解释什么是包埋共沉淀
包埋共沉淀(occlusion coprecipitation):由于沉淀形成速度快,吸附在表面的杂质或母液来不及离开,被随后长大的沉淀所覆盖,包藏在沉淀内部引起的共沉淀。减少或消除包埋共沉淀的方法是使沉淀重结晶或陈化。
58.铬酸钾指示剂法需要哪些滴定条件
(1)终点到达的迟早与溶液中指示剂的浓度有关。为达到终点恰好与等当点一致的目的,必须控制溶液中CrO42-的浓度。每50~100ml滴定溶液中加入5%(W/V)K2CrO4溶液1ml就可以了。
(2)用K2CrO4作指示剂,滴定不能在酸性溶液中进行,因指示剂K2CrO4是弱酸盐,在酸性溶液中CrO42-依下列反应与H+离子结合,使CrO42-浓度降低过多,在等当点不能形成Ag2CrO4沉淀。
(3)用铬酸钾指示剂法,滴定只能在近中性或弱碱性溶液(pH6.5~10.5)中进行。
(4)滴定不能在氨性溶液中进行,因AgCl和Ag2CrO4皆可生成[Ag(NH3)2]+而溶解。
59.解释硫酸铁铵指示剂法的原理及滴定反应
硫酸铁铵指示剂法原理是在酸性溶液中,用NH4SCN(或KSCN)为滴定液滴定Ag+,以Fe3+为指示剂的滴定方法。
滴定反应为:
终点前Ag++SCN-→AgSCN↓
终点时Fe3++SCN-→Fe(SCN)2+(淡棕红色)
60.硫酸铁铵指示剂法滴定应该注意的事项
a 为防止Fe3+的水解,应在酸性(HNO3)溶液中进行滴定,在酸性溶液中,Al3+、Zn2+、Ba2+及CO32-等离子的存在也不干扰。与铬酸钾指示剂法相比,这是本法的最大优点。
b 为避免由于沉淀吸附Ag+过早到达终点,在用硝基苯包裹AgCl沉淀时,临近终点应轻轻旋摇,以免沉淀转化,直到溶液出现稳定的淡棕红色为止。
c 本法测定I-和Br-时,由于AgI和AgBr的溶解度都小于AgCl的溶解度,不存在沉淀转化问题,不需加入有机溶剂或滤去沉淀,滴定终点明显确切。
d 滴定不宜在较高温度下进行,否则红色络合物褪色。
61.吸附指示剂法的原理
吸附指示剂法原理:用AgNO3液为滴定液,以吸附指示剂指示终点,测定卤化物的滴定方法。吸附指示剂是一些有机染料,它们的阴离子在溶液中很容易被带正电荷的胶态沉淀所吸附,而不被带负电荷的胶态沉淀所吸附,并且在吸附后结构变形发生颜色改变。