题目
8.在101.325kPa条件下把一个极微小的冰块作为晶种投入100 g温度为268K的过冷水中,结-|||-果使系统温度升至273K,并有一定数量的水凝结为冰。由于该过程进行得很快,可以看做是绝热的。-|||-已知冰的熔化热为 .00kJcdot mo(l)^-1 在 approx 273k 之间水的摩尔定压热容为 .86] cdot mo(L)^-1cdot (K)^-1 求-|||-此过程的 Delta H 及可析出多少克冰?

题目解答
答案
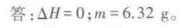
解析
考查要点:本题主要考查相变过程中的热力学计算,涉及绝热过程、焓变的定义,以及热平衡方程的应用。
解题核心思路:
- ΔH的判断:在恒压绝热过程中,系统的焓变ΔH等于过程中的热交换Q_p。由于过程绝热,Q_p=0,因此ΔH=0。
- 析冰质量计算:通过热平衡建立方程,即过冷水升温吸收的热量等于结冰释放的潜热。
破题关键点:
- 绝热条件导致系统内部热量守恒。
- 相变潜热与温度变化的热量需精确计算。
1. 计算ΔH
在恒压绝热过程中,焓变ΔH等于过程中的热交换Q_p。由于过程绝热,外界与系统无热量交换(Q_p=0),因此:
$\Delta H = Q_p = 0$
2. 计算析出冰的质量
步骤1:确定过冷水升温的热量
过冷水质量为100g,摩尔数为:
$n_{\text{水}} = \frac{100}{18.015} \approx 5.55 \, \text{mol}$
温度从268K升至273K,温升ΔT=5K。升温吸收的热量为:
$Q_{\text{升温}} = n_{\text{水}} \cdot C_p \cdot \Delta T = 5.55 \cdot 75.86 \cdot 5 \approx 2050 \, \text{J}$
步骤2:确定结冰释放的热量
设析出冰的质量为$m$,对应的物质的量为$n_{\text{冰}} = \frac{m}{18.015}$。结冰释放的潜热为:
$Q_{\text{结冰}} = n_{\text{冰}} \cdot \Delta H_{\text{熔}} = \frac{m}{18.015} \cdot 6000 \, \text{J}$
步骤3:热平衡方程
绝热条件下,升温吸收的热量等于结冰释放的热量:
$2050 = \frac{m}{18.015} \cdot 6000$
解得:
$m = \frac{2050 \cdot 18.015}{6000} \approx 6.32 \, \text{g}$