题目
,不是同一形状平行四边形的最小体积者以及不符合平移特征的图形均不得分。6-3据报道,该晶体是以Na0.7CoO2为起始物,先跟溴反应,然后用水洗涤而得到的。写出起始物和溴的反应方程式。Na0.7CoO2+ 0.35/2 Br2= Na0.35CoO2+ 0.35 NaBr(2分;未配平不给分。)第7题(5分)杜邦公司因发明了一项新技术而获得了2003年美国总统绿色化学奖。该技术利用基因工程将酵母菌的基因引入一种大肠杆菌,用来将葡萄糖发酵生成1.3-丙二醇。7-1在上述发酵过程中,葡萄糖首先转化为二羟基丙酮的一磷酸酯,随后转化为目标产物。该反应对于葡萄糖的原子利用率为______%。原子利用率是目标产物的相对分子质量除以反应物相对原子质量之和乘以100%。(2分)7-2生产1.3-丙二醇的传统工艺是以石油为原料按下述路线进行的:石油→乙烯→环氧乙烷→3-羟基丙醛→1.3-丙二醇。获得3-羟基丙醛的反应在乙醚溶剂中进行,用钴催化剂或铑催化剂,温度80oC,压力107Pa;后一反应用镍催化剂,温度80-120oC,压力1.6x107Pa。对比之下,新工艺至少具有以下3种绿色化学特征:原子利用率高,使用了可再生的植物资源,反应在温和条件下进行因而能耗低,不使用贵金属催化剂,不使用有机溶剂,有毒污染物排放少,反应在温和条件进行而不使用高压设备,……。(共3分;每答出上列各点之一给1分。)第8题(12分)8-1(4分)1摩尔高锰酸钾在240-300oC加热释放出19.2 g氧气,写出反应方程式。(已知K2MnO4640oC分解,K3MnO4800oC分解。)5KMnO4= K2MnO4+ K3MnO4+ 3MnO2+ 3O2(4分)8-2(3分)咖啡因对中枢神经有兴奋作用,其结构式如下。常温下,咖啡因在水中的溶解度为2 g/100g H2O,加适量水杨酸钠[C6H4(OH)(COONa)],由于形成氢键而增大咖啡因的溶解度。请在附图上添加水杨酸钠与咖啡因形成的氢键。Q CH3-|||-H3C- N-|||-N COONa-|||-N^---HO-|||-O N-|||-CH3(3分) (不要求氢键的键角和方向,但要求画在有孤对电子的氮原子上。)8-3(2分)阿司匹林结构式如下,难溶于水。若和适量柠檬酸三钠混合,即可增大溶解度。解释原因。Q CH3-|||-H3C- N-|||-N COONa-|||-N^---HO-|||-O N-|||-CH3阿司匹林中的羧酸和柠檬酸根反应形成阿司匹林的钠盐。(2分)(若写方程式表达得分相同,但必须配平。)8-4(3分)氯仿在苯中的溶解度明显比1,1,1-三氯乙烷的大,请给出一种可能的原因(含图示)。Q CH3-|||-H3C- N-|||-N COONa-|||-N^---HO-|||-O N-|||-CH3(2分)CHCl3的氢原子与苯环的共軛电子形成氢键。(1分)(若只写“氢键”给1分。)第9题(6分)钒是我国丰产元素,储量占全球11%,居第四位。在光纤通讯系统中,光纤将信息导入离光源1km外的用户就需用5片钒酸钇晶体(钇是第39号元素)。我国福州是全球钒酸钇晶体主要供应地,每年出口几十万片钒酸钇晶体,年创汇近千万美元(1999年)。钒酸钇是四方晶体,晶胞参数a= 712 pm,c= 629 pm,密度d= 4.22 g/cm3,含钒25%,求钒酸钇的化学式以及在一个晶胞中有几个原子。给出计算过程。钒酸钇的化学式:YVO4(1分)计算过程:YVO4的摩尔质量为203.8 g/mol;钒的质量分数为50.9/203.8=025合题意。203.8/4.22 = 48.3 cm3/mol四方晶胞的体积V= 7122X629X10-30cm3=3.18X10-22cm3(1分)48.3/6.02X1023= 8.02X10-23cm3(1分)3.18X10-22/8.02X10-23= 3.97 ≈ 4(1分)一个晶胞中的原子数:4X6=24(2分)(类似过程或步骤合并,得分相同)第10题(12分)美国Monsando公司生产了一种除草剂,结构如下图,酸式电离常数如下:pKa10.8, pKa22.3 , pKa36.0 , pKa411.0。与它配套出售的是转基因作物(大豆、棉花、玉米、油菜籽)的种子,转入了抗御该除草剂的基因,喷洒该除草剂后其他植物全部死光,唯独这些作物茁壮成长,由此该除草剂得名Roundup,可意译为“一扫光”。这四种转基因作物已在美国大量种植,并已向我国和巴西等国大量出口,但欧洲至今禁止进口。Q CH3-|||-H3C- N-|||-N COONa-|||-N^---HO-|||-O N-|||-CH310-1Roundup为无色晶体,熔点高达200oC,根据如上结构式进行的分子间作用力(包括氢键)的计算,不能解释其高熔点。试问:Roundup在晶体中以什么型式存在?写出它的结构式。Q CH3-|||-H3C- N-|||-N COONa-|||-N^---HO-|||-O N-|||-CH3(2分)(电荷符号不加圈也可)10-2加热至200~230oC,Roundup先熔化,后固化,得到一种极易溶于水的双聚体A,其中有酰胺键,在316oC高温下仍稳定存在,但在无机强酸存在下回流,重新转化为Roundup。画出A的结构式。Q CH3-|||-H3C- N-|||-N COONa-|||-N^---HO-|||-O N-|||-CH3(3分)(不要求侧链的键角)10-3Roundup的植物韧皮的体液的pH约为8;木质部和细胞内液的pH为5~6。试写出Roundup后三级电离的方程式(方程式中的型体附加①②③④标注),并问:Roundup在植物轫皮液和细胞内液的主要存在型体(用你定义的①②③④表达)。提示:通常羧酸的电离常数介于磷酸的一、二级电离常数之间。-电离方程式:Q CH3-|||-H3C- N-|||-N COONa-|||-N^---HO-|||-O N-|||-CH3(3分,每式1分)植物轫皮液的主要型体:③(1分)细胞内液的主要型体:②(和③)(1分)10-4只有把Roundup转化为它的衍生物,才能测定它的pK1,问:这种衍生物是什么?这种衍生物是Roundup的强酸盐。(2分)(答盐酸盐等也可)第11题(10分)某烯烃混合物的摩尔分数为十八碳-3,6,9-三烯9%,十八碳-3,6-二烯57%,十八碳-3-烯34%。11-1烯烃与过氧乙酸可发生环氧化反应,请以十八碳-3,6,9-三烯为例,写出化学反应方程式。C2H5-CH=CH-CH2-CH=CH-CH2-CH=CH-C8H17+ 3CH3COOOH= C2H5-CH-CH-CH2-CH-CH-CH2-CH-CH-C8H17+ 3CH3COOH (2分)O O O11-2若所有的双键均被环氧化,计算1摩尔该混合烯烃需要多少摩尔过氧乙酸。1摩尔十八碳三烯环氧化需3摩尔过氧乙酸;1摩尔十八碳二烯环氧化需2摩尔过氧乙酸;1摩尔十八烯环氧化需1摩尔过氧乙酸,因此:1摩尔混合烯完全过氧化需过氧乙酸:0.09X3 +0.57X2 +0.34X1 = 1.75 mol (2分)11-3若上述混合烯烃中只有部分不饱和键环氧化,请设计一个实验方案,用酸碱滴定法测定分离后产物的环氧化程度:简述实验方案;写出相关的反应方程式和计算环氧化程度(%)的通式。实验方案:用已知过量的氯化氢(n/mol)与环氧化并经分离后的混合烯烃反应,反应完成后,用已知浓度的氢氧化钠标准溶液(c/mol·L-1)滴定反应剩余的酸,记录滴定终点氢氧化钠溶液的体积(V/mL)。(2分;若未写“分离后”,扣1分)相关方程式:R-CH-CH-R’ + HCl = R-CH-CH-R’O HO Cl(写出此式即得满分)NaOH + HCl = NaCl + H2O(2分)计算式:环氧化程度(%)=[(n-cV/1000)/1.75]X100%(写出此式即得满分)设x,y,z分别为三烯、二烯和单烯的摩尔分数,则计算通式为:环氧化程度(%)=[(n-cV/1000)/(3x+2y+z)]X100%(2分)第12题(12分)中和1.2312 g平面构型的羧酸消耗18.00 mL 1.20 mol/L NaOH溶液,将该羧酸加热脱水,生成含碳量为49.96%的化合物。确定符合上述条件的摩尔质量最大的羧酸及其脱水产物的结构式,简述推理过程。羧酸的结构式:Q CH3-|||-H3C- N-|||-N COONa-|||-N^---HO-|||-O N-|||-CH3脱水产物的结构式;Q CH3-|||-H3C- N-|||-N COONa-|||-N^---HO-|||-O N-|||-CH3(每式3分,共6分。)推理过程:(6分,参考答案如下,分值的大致分配:n=1,2,3,4,5,6各占1分。其他符合逻辑的应答也可,不完整应扣分。)设羧酸为n元酸,则:羧酸的摩尔质量为M= 1.2312 g/[(1.20 mol/LX18.00 mL/1000)/n] = 57ng/mol羧基(COOH)的摩尔质量为45 g/mol,对于n元酸,n个羧基的摩尔质量为45ng/mol,n元酸分子中除羧基外的基团的摩尔质量为(57-45)Xn=12n,n=1,2,3,4……,该基团只能是n个碳原子才能保证羧酸的摩尔质量为57ng/mol。对于一元酸:n=1,结构为:C-COOH,不存在。对于二元酸:n=2,结构为HOOC-C≡C-COOH(尚非最大摩尔质量平面结构)对于三元酸:n=3,无论3个碳呈链状结构还是三元环结构,都不存在。对于四元酸:n=4,结构为:Q CH3-|||-H3C- N-|||-N COONa-|||-N^---HO-|||-O N-|||-CH3或Q CH3-|||-H3C- N-|||-N COONa-|||-N^---HO-|||-O N-|||-CH3或Q CH3-|||-H3C- N-|||-N COONa-|||-N^---HO-|||-O N-|||-CH3第一个结构符合题意,但尚非最大摩尔质量的平面结构羧酸(注;且不能稳定存在)后两者具非平面结构,不符合题意。(最右边的结构可不写)五元酸跟三元酸一样不能存在。(或得出结论:n为奇数均不能成立。)对于六元酸:n=6,羧酸及其脱水产物结构式如上。羧酸具平面结构,符合题意。脱水产物的碳含量=12MC/(12MC+9MO) = 50%。符合题意。n更大,不可能再出现平面结构的羧酸。(或用碳架结构表示)
,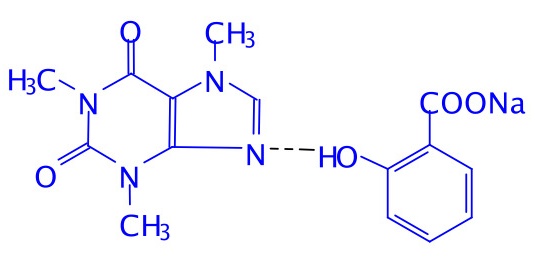 (3分) (不要求氢键的键角和方向,
(3分) (不要求氢键的键角和方向,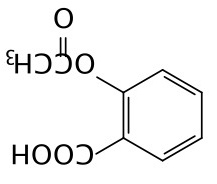 阿司匹林中的羧酸和柠檬酸根反应形成阿司匹林的钠盐。(2分)
阿司匹林中的羧酸和柠檬酸根反应形成阿司匹林的钠盐。(2分)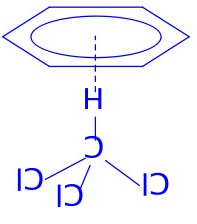 (2分)CHCl3的氢原子与苯环的共軛电子形成氢键。(1分)
(2分)CHCl3的氢原子与苯环的共軛电子形成氢键。(1分)
 (2分)(电荷符号不加圈也可)
(2分)(电荷符号不加圈也可)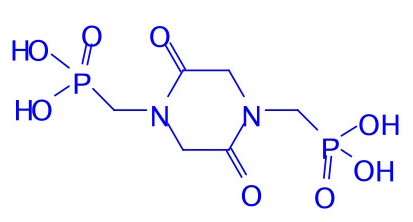 (3分)(不要求侧链的键角)
(3分)(不要求侧链的键角)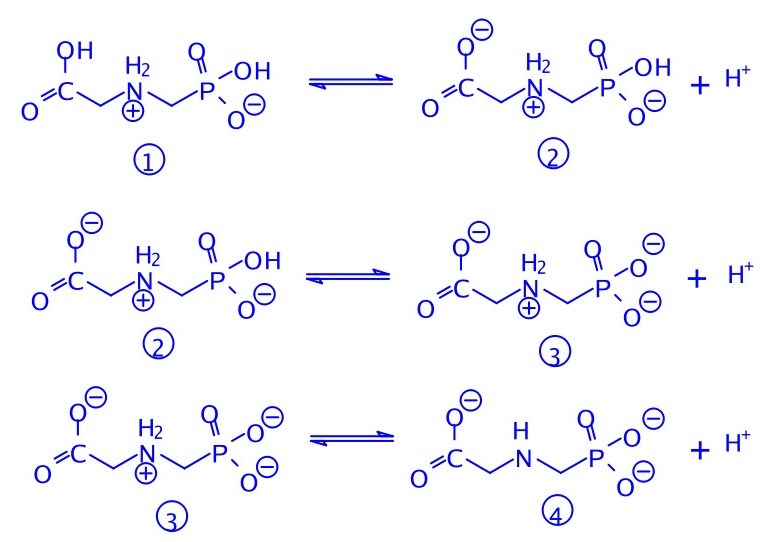
 或
或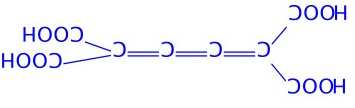 或
或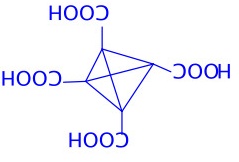
不是同一形状平行四边形的最小体积者以及不符合平移特征的图形均不得分。
6-3据报道,该晶体是以Na0.7CoO2为起始物,先跟溴反应,然后用水洗涤而得到的。写出起始物和溴的反应方程式。
Na0.7CoO2+ 0.35/2 Br2= Na0.35CoO2+ 0.35 NaBr(2分;未配平不给分。)
第7题(5分)杜邦公司因发明了一项新技术而获得了2003年美国总统绿色化学奖。该技术利用基因工程将酵母菌的基因引入一种大肠杆菌,用来将葡萄糖发酵生成1.3-丙二醇。
7-1在上述发酵过程中,葡萄糖首先转化为二羟基丙酮的一磷酸酯,随后转化为目标产物。该反应对于葡萄糖的原子利用率为______%。原子利用率是目标产物的相对分子质量除以反应物相对原子质量之和乘以100%。(2分)
7-2生产1.3-丙二醇的传统工艺是以石油为原料按下述路线进行的:石油→乙烯→环氧乙烷→3-羟基丙醛→1.3-丙二醇。获得3-羟基丙醛的反应在乙醚溶剂中进行,用钴催化剂或铑催化剂,温度80oC,压力107Pa;后一反应用镍催化剂,温度80-120oC,压力1.6x107Pa。对比之下,新工艺至少具有以下3种绿色化学特征:
原子利用率高,使用了可再生的植物资源,反应在温和条件下进行因而能耗低,不使用贵金属催化剂,不使用有机溶剂,有毒污染物排放少,反应在温和条件进行而不使用高压设备,……。(共3分;每答出上列各点之一给1分。)
第8题(12分)
8-1(4分)1摩尔高锰酸钾在240-300oC加热释放出19.2 g氧气,写出反应方程式。
(已知K2MnO4640oC分解,K3MnO4800oC分解。)
5KMnO4= K2MnO4+ K3MnO4+ 3MnO2+ 3O2(4分)
8-2(3分)咖啡因对中枢神经有兴奋作用,其结构式如下。常温下,咖啡因在水中的溶解度为2 g/100g H2O,加适量水杨酸钠[C6H4(OH)(COONa)],由于形成氢键而增大咖啡因的溶解度。请在附图上添加水杨酸钠与咖啡因形成的氢键。
 (3分) (不要求氢键的键角和方向,
(3分) (不要求氢键的键角和方向,但要求画在有孤对电子的氮原子上。)
8-3(2分)阿司匹林结构式如下,难溶于水。若和适量柠檬酸三钠混合,即可增大溶解度。解释原因。
 阿司匹林中的羧酸和柠檬酸根反应形成阿司匹林的钠盐。(2分)
阿司匹林中的羧酸和柠檬酸根反应形成阿司匹林的钠盐。(2分)(若写方程式表达得分相同,但必须配平。)
8-4(3分)氯仿在苯中的溶解度明显比1,1,1-三氯乙烷的大,请给出一种可能的原因(含图示)。
 (2分)CHCl3的氢原子与苯环的共軛电子形成氢键。(1分)
(2分)CHCl3的氢原子与苯环的共軛电子形成氢键。(1分)(若只写“氢键”给1分。)
第9题(6分)钒是我国丰产元素,储量占全球11%,居第四位。在光纤通讯系统中,光纤将信息导入离光源1km外的用户就需用5片钒酸钇晶体(钇是第39号元素)。我国福州是全球钒酸钇晶体主要供应地,每年出口几十万片钒酸钇晶体,年创汇近千万美元(1999年)。钒酸钇是四方晶体,晶胞参数a= 712 pm,c= 629 pm,密度d= 4.22 g/cm3,含钒25%,求钒酸钇的化学式以及在一个晶胞中有几个原子。给出计算过程。
钒酸钇的化学式:YVO4(1分)
计算过程:YVO4的摩尔质量为203.8 g/mol;钒的质量分数为50.9/203.8=025合题意。
203.8/4.22 = 48.3 cm3/mol四方晶胞的体积V= 7122X629X10-30cm3=3.18X10-22cm3(1分)
48.3/6.02X1023= 8.02X10-23cm3(1分)
3.18X10-22/8.02X10-23= 3.97 ≈ 4(1分)
一个晶胞中的原子数:4X6=24(2分)(类似过程或步骤合并,得分相同)
第10题(12分)美国Monsando公司生产了一种除草剂,结构如下图,酸式电离常数如下:pKa10.8, pKa22.3 , pKa36.0 , pKa411.0。与它配套出售的是转基因作物(大豆、棉花、玉米、油菜籽)的种子,转入了抗御该除草剂的基因,喷洒该除草剂后其他植物全部死光,唯独这些作物茁壮成长,由此该除草剂得名Roundup,可意译为“一扫光”。这四种转基因作物已在美国大量种植,并已向我国和巴西等国大量出口,但欧洲至今禁止进口。

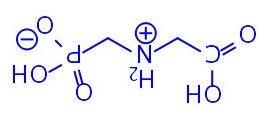
10-1Roundup为无色晶体,熔点高达200oC,根据如上结构式进行的分子间作用力(包括氢键)的计算,不能解释其高熔点。试问:Roundup在晶体中以什么型式存在?写出它的结构式。
 (2分)(电荷符号不加圈也可)
(2分)(电荷符号不加圈也可)10-2加热至200~230oC,Roundup先熔化,后固化,得到一种极易溶于水的双聚体A,其中有酰胺键,在316oC高温下仍稳定存在,但在无机强酸存在下回流,重新转化为Roundup。画出A的结构式。
 (3分)(不要求侧链的键角)
(3分)(不要求侧链的键角)10-3Roundup的植物韧皮的体液的pH约为8;木质部和细胞内液的pH为5~6。试写出Roundup后三级电离的方程式(方程式中的型体附加①②③④标注),并问:Roundup在植物轫皮液和细胞内液的主要存在型体(用你定义的①②③④表达)。提示:通常羧酸的电离常数介于磷酸的一、二级电离常数之间。
-
电离方程式:

(3分,每式1分)
植物轫皮液的主要型体:③(1分)细胞内液的主要型体:②(和③)(1分)
10-4只有把Roundup转化为它的衍生物,才能测定它的pK1,问:这种衍生物是什么?
这种衍生物是Roundup的强酸盐。(2分)(答盐酸盐等也可)
第11题(10分)某烯烃混合物的摩尔分数为十八碳-3,6,9-三烯9%,十八碳-3,6-二烯57%,十八碳-3-烯34%。
11-1烯烃与过氧乙酸可发生环氧化反应,请以十八碳-3,6,9-三烯为例,写出化学反应方程式。
C2H5-CH=CH-CH2-CH=CH-CH2-CH=CH-C8H17+ 3CH3COOOH
= C2H5-CH-CH-CH2-CH-CH-CH2-CH-CH-C8H17+ 3CH3COOH (2分)
O O O
11-2若所有的双键均被环氧化,计算1摩尔该混合烯烃需要多少摩尔过氧乙酸。
1摩尔十八碳三烯环氧化需3摩尔过氧乙酸;1摩尔十八碳二烯环氧化需2摩尔过氧乙酸;1摩尔
十八烯环氧化需1摩尔过氧乙酸,因此:1摩尔混合烯完全过氧化需过氧乙酸:
0.09X3 +0.57X2 +0.34X1 = 1.75 mol (2分)
11-3若上述混合烯烃中只有部分不饱和键环氧化,请设计一个实验方案,用酸碱滴定法测定分离后产物的环氧化程度:简述实验方案;写出相关的反应方程式和计算环氧化程度(%)的通式。
实验方案:用已知过量的氯化氢(n/mol)与环氧化并经分离后的混合烯烃反应,反应完
成后,用已知浓度的氢氧化钠标准溶液(c/mol·L-1)滴定反应剩余的酸,记录滴
定终点氢氧化钠溶液的体积(V/mL)。(2分;若未写“分离后”,扣1分)
相关方程式:R-CH-CH-R’ + HCl = R-CH-CH-R’
O HO Cl(写出此式即得满分)
NaOH + HCl = NaCl + H2O(2分)
计算式:环氧化程度(%)=[(n-cV/1000)/1.75]X100%(写出此式即得满分)
设x,y,z分别为三烯、二烯和单烯的摩尔分数,则计算通式为:
环氧化程度(%)=[(n-cV/1000)/(3x+2y+z)]X100%(2分)
第12题(12分)中和1.2312 g平面构型的羧酸消耗18.00 mL 1.20 mol/L NaOH溶液,将该羧酸加热脱水,生成含碳量为49.96%的化合物。确定符合上述条件的摩尔质量最大的羧酸及其脱水产物的结构式,简述推理过程。
羧酸的结构式: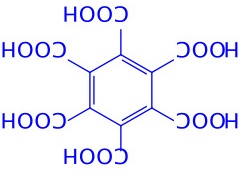 脱水产物的结构式;
脱水产物的结构式;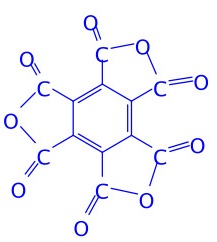
 脱水产物的结构式;
脱水产物的结构式;
(每式3分,共6分。)
推理过程:(6分,参考答案如下,分值的大致分配:n=1,2,3,4,5,6各占1分。
其他符合逻辑的应答也可,不完整应扣分。)
设羧酸为n元酸,则:
羧酸的摩尔质量为M= 1.2312 g/[(1.20 mol/LX18.00 mL/1000)/n] = 57ng/mol
羧基(COOH)的摩尔质量为45 g/mol,对于n元酸,n个羧基的摩尔质量为45ng/mol,
n元酸分子中除羧基外的基团的摩尔质量为(57-45)Xn=12n,n=1,2,3,4……,
该基团只能是n个碳原子才能保证羧酸的摩尔质量为57ng/mol。
对于一元酸:n=1,结构为:C-COOH,不存在。
对于二元酸:n=2,结构为HOOC-C≡C-COOH(尚非最大摩尔质量平面结构)
对于三元酸:n=3,无论3个碳呈链状结构还是三元环结构,都不存在。
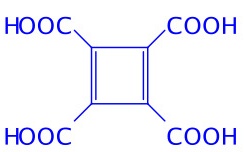
对于四元酸:n=4,结构为:
 或
或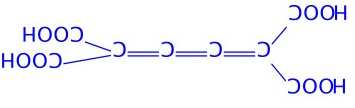 或
或
第一个结构符合题意,但尚非最大摩尔质量的平面结构羧酸(注;且不能稳定存在)
后两者具非平面结构,不符合题意。(最右边的结构可不写)
五元酸跟三元酸一样不能存在。(或得出结论:n为奇数均不能成立。)
对于六元酸:n=6,羧酸及其脱水产物结构式如上。羧酸具平面结构,符合题意。
脱水产物的碳含量=12MC/(12MC+9MO) = 50%。符合题意。
n更大,不可能再出现平面结构的羧酸。(或用碳架结构表示)
题目解答
答案
+ 3.65 84