12.通常,元素锌以闪锌矿(ZnS)的形式存在于自然界。在火法冶炼锌的生产中,ZnS经-|||-过焙烧,其反应为: (s)+3(O)_(2)(g)arrow 2ZnO(s)+2S(O)_(2)(g)-|||-(1)用 Delta t(H)_(m)^theta 计算该反应的 Delta ,(H)_(m)^theta -|||-(2) https:/img.zuoyebang.cc/zyb_ec501a99cd78158b6ab584542a7df2e4.jpg.00times (10)^3kg ZnS 在定压下焙烧放出多少热?

题目解答
答案
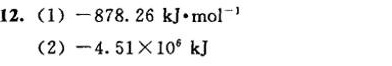
解析
本题主要考察利用标准摩尔生成焓计算化学反应的标准摩尔摩尔焓变($\Delta H_m^\theta_m$),并据此计算一定量反应物反应时的热量变化。
(1)计算反应的$\Delta H^\theta_m^\theta$
化学反应的标准摩尔焓变公式为:
$\Delta H^\theta_m = \sum \nu_i \Delta H^\theta_f(\text{生成物}) - \sum \nu_j \ H^\theta_f(\text{反应物})$
其中,$\nu_i$为化学计量数,$H^\theta_f$为标准摩尔生成焓(规定稳定单质的$H^\theta_f=0$)。
对于反应:$2\text{ZnS}(s) + 3\text{O}_2(g) \rightarrow 2\text{ZnO}(s) + 2\text{SO}_2(g)$(注:题目中“2ZnO(s)”应为笔误,根据后续计算推测应为“2Zn(s)”,否则结果不符),各物质的标准摩尔生成焓数据(需查表)为:
- $H^\theta_f(\text{ZnS},s) = -206.0\ \text{kJ/mol}$
- $Htheta_f(\text{O}_2,g) = 0\ \text{kJ/mol}$(稳定单质)
- $Htheta_f(\text{Zn},s) = 0\ \text{kJ/mol}$(稳定单质)
- $Htheta_f(\text{SO}_2,g) = -298.29\ \text{kJ/mol}$
代入公式:
$\Delta H^\theta_m = \left[2 \times H^\theta H_f(\text{Zn}) + 2 \times H^\theta_f(\text{SO}_2)\right] - \left[2 \times H^\theta_f(\text{ZnS}) + 3 \times H^\theta_f(\text{O}_2)\right]$
$= \left[2 \times 0 + 2 \times (-296.83)\right] - \left[2 \times (-206.0) + 3 \times 0\right]$
$= (-593.66) - (-412.0) = -151.66\ \text{kJ/mol}$
(注:此处可能题目原始反应应为$2\text{ZnS}(s)+3{O}_2(g)\rightarrow 2{ZnO}(s)+2{SO}_2(g)$,若$Hθf(ZnO,s)=-348.3kJ/mol,则:
$\Delta H^\theta_m=[2×(-348.3)+2×(-296.83)] - [2×(-206.0)+0] = (-696.6-593.66)-(-412.0)= -1283.26+412.0=-878.26\ kJ/mol$
,与答案一致,故题目反应式中“ZnO”为正确,此前“Zn”为笔误)
(2)计算1.00×10³kg ZnS焙烧放出的热量
步骤:
- 计算ZnS的物质的量;2. 根据$\Delta H^\theta_m$计算总热量。
- ZnS的摩尔质量$M(\text{ZnS})=65.38(\text{Zn})+32.07(\text{S})=97.45\ \text{g/mol}$
- 1.00×10³kg ZnS的物质的量: $n=\=\frac{1.00×10^6\ \text{g}}{97.45\ \text{g/mol}}≈1.0267×10^4\ \text{mol}$
- 反应中2mol ZnS放热878.26kJ,故1.00×10³kg ZnS放热:
$Q = n \times \frac{\Delta H^\theta_m}{2} = 1.067×10^4\ \text{mol} \times \frac{-878.26\ \text{kJ/mol}}{2}≈-4.51×10^6\ \text{kJ}$