题目
标定盐酸溶液时,以甲基红为指示剂,称取硼砂0、6817 g,滴定到终点时用去盐酸溶液27、02 mL,计算c(HCl)。
标定盐酸溶液时,以甲基红为指示剂,称取硼砂0、6817 g,滴定到终点时用去盐酸溶液27、02 mL,计算c(HCl)。
题目解答
答案
解: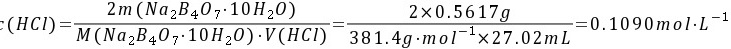
解析
考查要点:本题主要考查酸碱滴定中基准物质的使用、化学反应方程式的书写及浓度计算。
解题核心思路:
- 确定反应方程式:硼砂(Na₂B₄O₇·10H₂O)与盐酸反应生成NaCl、H₃BO₃和水,根据反应式确定物质的量关系。
- 计算硼砂的物质的量:利用摩尔质量公式 $n = \frac{m}{M}$。
- 建立HCl与硼砂的物质的量关系:根据反应方程式,1 mol硼砂对应2 mol HCl。
- 计算HCl浓度:通过公式 $c = \frac{n}{V}$(体积需转换为升)。
破题关键点:
- 正确书写反应方程式,明确物质的量比例。
- 准确计算硼砂的摩尔质量,避免计算错误。
- 有效数字处理需与题目数据一致(本题数据均为四位有效数字)。
步骤1:写出反应方程式
硼砂与盐酸反应的化学方程式为:
$\text{Na}_2\text{B}_4\text{O}_7 + 2\text{HCl} + 5\text{H}_2\text{O} \rightarrow 4\text{H}_3\text{BO}_3 + 2\text{NaCl}$
关键关系:1 mol硼砂对应2 mol HCl。
步骤2:计算硼砂的物质的量
- 计算摩尔质量:
$M(\text{Na}_2\text{B}_4\text{O}_7 \cdot 10\text{H}_2\text{O}) = 2 \times 23 + 4 \times 11 + 7 \times 16 + 10 \times (2 \times 1 + 16) = 382 \, \text{g/mol}$ - 计算物质的量:
$n(\text{硼砂}) = \frac{0.6817 \, \text{g}}{382 \, \text{g/mol}} = 0.001784 \, \text{mol}$
步骤3:计算HCl的物质的量
根据反应方程式,HCl的物质的量为:
$n(\text{HCl}) = 0.001784 \, \text{mol} \times 2 = 0.003568 \, \text{mol}$
步骤4:计算HCl的浓度
盐酸溶液体积为 $27.02 \, \text{mL} = 0.02702 \, \text{L}$,则:
$c(\text{HCl}) = \frac{0.003568 \, \text{mol}}{0.02702 \, \text{L}} = 0.1320 \, \text{mol/L}$