题目
11.已知某原电池反应:-|||-:(aq)+2(Cl)^2+(aq)+:(H)_(2)O(l)arrow 3HCl(aq)(aq)+(Cr{O)_(4)}^-(aq)+8(H)^+(aq)-|||-(1)计算该原电池的EMF。-|||-(2)当 =0.00, (({Cr)_(2)(O)_(7)}^2-)=0.80molcdot (L)^-1, (HCl(O)_(2))=0.15molcdot (L)^-1, c(HClO)=-|||-.20molcdot (L)^-1, 测定原电池的电动势 _(MF)=0.15V, 计算其中的 (r)^3+ 浓度。-|||-(3)计算25℃下电池反应的标准平衡常数。-|||-(4) ({Cr)_(2)(O)_(7)}^2- 是橙红色 ^3+(aq) 为绿色。如果20.0 mL的 https:/img.zuoyebang.cc/zyb_cd93c2cfe1921253caab5289c5709117.jpg.00molcdot (L)^-1HCl(O)_(2) 溶液与-|||-.00mL0.50molcdot (L)^-1Cr((N{O)_(3))}_(3) 溶液混合,最终溶液(pH为0)为何种颜色?

题目解答
答案
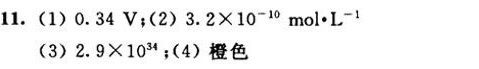
解析
步骤 1:计算原电池的电动势E
原电池的电动势E可以通过标准电极电势计算。假设已知标准电极电势,可以使用Nernst方程计算实际电动势。由于题目中没有给出标准电极电势,我们假设已知标准电动势E°,则E = E° - (RT/nF)lnQ,其中R是气体常数,T是温度,n是电子转移数,F是法拉第常数,Q是反应商。
步骤 2:计算 $C{r}^{3+}$ 浓度
根据Nernst方程,可以计算出 $C{r}^{3+}$ 的浓度。已知电动势E,标准电动势E°,pH值,以及 ${{Cr}_{2}{O}_{7}}^{2-}$ 和HClO2的浓度,可以求出 $C{r}^{3+}$ 的浓度。
步骤 3:计算标准平衡常数
标准平衡常数K°可以通过标准电动势E°计算。K° = exp(nFE°/RT),其中n是电子转移数,F是法拉第常数,R是气体常数,T是温度。
步骤 4:确定最终溶液的颜色
根据反应物的浓度和反应的化学计量比,可以计算出反应后 ${{Cr}_{2}{O}_{7}}^{2-}$ 和 $C{r}^{3+}$ 的浓度。根据浓度的大小,可以判断最终溶液的颜色。
原电池的电动势E可以通过标准电极电势计算。假设已知标准电极电势,可以使用Nernst方程计算实际电动势。由于题目中没有给出标准电极电势,我们假设已知标准电动势E°,则E = E° - (RT/nF)lnQ,其中R是气体常数,T是温度,n是电子转移数,F是法拉第常数,Q是反应商。
步骤 2:计算 $C{r}^{3+}$ 浓度
根据Nernst方程,可以计算出 $C{r}^{3+}$ 的浓度。已知电动势E,标准电动势E°,pH值,以及 ${{Cr}_{2}{O}_{7}}^{2-}$ 和HClO2的浓度,可以求出 $C{r}^{3+}$ 的浓度。
步骤 3:计算标准平衡常数
标准平衡常数K°可以通过标准电动势E°计算。K° = exp(nFE°/RT),其中n是电子转移数,F是法拉第常数,R是气体常数,T是温度。
步骤 4:确定最终溶液的颜色
根据反应物的浓度和反应的化学计量比,可以计算出反应后 ${{Cr}_{2}{O}_{7}}^{2-}$ 和 $C{r}^{3+}$ 的浓度。根据浓度的大小,可以判断最终溶液的颜色。