题目
某化学教师在一次化学测验中设计了下面试题,并对学生的解题结果进行了统计和分析。【试题】常温下,浓度均为0.1mol·L-1,体积均为100mL的两种一元酸HX、HY。下列说法不正确的是()。A.此时若HY的pH=3,则HY是弱酸B.若HY的pH=l,则水电离出的c(H+)=1x10-13mol·L-1C.若分别加入0.01mol NaOH固体,则溶液pH均为7D.若分别加入0.01mol NaOH固体,则酸碱恰好完全中和【解题结果】对参加考试的全体学生的解题结果统计如表1所示:表1-|||-选项 A B C D-|||-比例 8.3% 29.5% 40.1% 22.1% 试根据上述信息,回答下列问题:(1)本题正确的答案是什么?讲评本题时,正确的解题思路是什么?(7分)(2)试对学生错选原因进行诊断和分析。(8分)
某化学教师在一次化学测验中设计了下面试题,并对学生的解题结果进行了统计和分析。
【试题】常温下,浓度均为0.1mol·L-1,体积均为100mL的两种一元酸HX、HY。下列说法不正确的是()。
A.此时若HY的pH=3,则HY是弱酸
B.若HY的pH=l,则水电离出的c(H+)=1x10-13mol·L-1
C.若分别加入0.01mol NaOH固体,则溶液pH均为7
D.若分别加入0.01mol NaOH固体,则酸碱恰好完全中和
【解题结果】对参加考试的全体学生的解题结果统计如表1所示:

试根据上述信息,回答下列问题:
(1)本题正确的答案是什么?讲评本题时,正确的解题思路是什么?(7分)
(2)试对学生错选原因进行诊断和分析。(8分)
题目解答
答案
(1)本题正确答案为C。

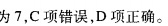
(2)误选A项的原因:不清楚pH、物质的量浓度与酸性强弱三者之间的关系。误选B项的原因:不清楚溶液的pH与其水中电离出的H+的关系或不记得常温下水的电离平衡常数。误选D项的原因:对于pH=7和完全中和的概念混淆。
解析
步骤 1:分析选项A
0.1mol·L^{-1}的HY的pH=3,表明HY没有完全电离,所以HY是弱酸,A项正确。
步骤 2:分析选项B
若HY的pH=1,则c(H^{+})=1×10^{-1}mol·L^{-1}。常温下,水的K_{w}=1×10^{-14},则水电离出的c(H^{+})=(1×10^{-14})÷(1×10^{-1})=1×10^{-13}mol·L^{-1},B项正确。
步骤 3:分析选项C
若分别加入0.01mol NaOH固体,则酸碱恰好完全中和,但是溶液的pH不一定为7,C项错误。
步骤 4:分析选项D
若分别加入0.01mol NaOH固体,则酸碱恰好完全中和,D项正确。
【答案】
C
(2)【解析】
误选A项的原因:不清楚pH、物质的量浓度与酸性强弱三者之间的关系。
误选B项的原因:不清楚溶液的pH与其水中电离出的H^{+}的关系或不记得常温下水的电离平衡常数。
误选D项的原因:对于pH=7和完全中和的概念混淆。
0.1mol·L^{-1}的HY的pH=3,表明HY没有完全电离,所以HY是弱酸,A项正确。
步骤 2:分析选项B
若HY的pH=1,则c(H^{+})=1×10^{-1}mol·L^{-1}。常温下,水的K_{w}=1×10^{-14},则水电离出的c(H^{+})=(1×10^{-14})÷(1×10^{-1})=1×10^{-13}mol·L^{-1},B项正确。
步骤 3:分析选项C
若分别加入0.01mol NaOH固体,则酸碱恰好完全中和,但是溶液的pH不一定为7,C项错误。
步骤 4:分析选项D
若分别加入0.01mol NaOH固体,则酸碱恰好完全中和,D项正确。
【答案】
C
(2)【解析】
误选A项的原因:不清楚pH、物质的量浓度与酸性强弱三者之间的关系。
误选B项的原因:不清楚溶液的pH与其水中电离出的H^{+}的关系或不记得常温下水的电离平衡常数。
误选D项的原因:对于pH=7和完全中和的概念混淆。