(6分)镁及其合金是一种用途广泛的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:海水(主要含 溶液A-|||-NaCl和 试剂①-|||-MgSO4等) 反应①-|||-Mg(OH)2沉淀-|||-试剂② MgCl2 无水 熔融电解-|||-反应② 溶液 MgCl2 反应③ Mg(1)镁在元素周期表中位于第__________周期,第___________族。(2)为使MgSO4完全转化为Mg(OH)2沉淀,试剂①可选用____________(填化学式),且加入试剂①的量应______________(选填“少量”或“过量”)。(3)若要检验溶液A中含有的SO42-,使用的试剂是_________________。A.④>③=②>① B.④③>④ D.④>③>②>①7.下列有关糖类、油脂、蛋白质的说法中,不正确的是( )A.灼烧蚕丝织物有烧焦羽毛的气味B.蔗糖和麦芽糖互为同分异构体C.蔗糖溶液中加入稀硫酸,水解后加入银氨溶液,水浴加热未出现银镜,说明水解的产物为非还原性糖D.利用油脂在碱性条件下的水解,可以制肥皂8.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是A.分液、萃取、蒸馏 B.萃取、蒸馏、分液C.分液、蒸馏、萃取 D.蒸馏、萃取、分液9.下列反应的离子方程式书写正确的是A.氯化铝溶液中加入过量氨水:A13++4NH3·H2O=AlO2-+ 4NH4++2H2OB.澄清石灰水与过量碳酸氢钠溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2OC.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2OD.氯化亚铁溶液中通入氯气:2Fe2++C12=2Fe3++2C1-10.下列实验操作和数据记录都正确的是( )A.用10mL量筒量取9.2 mL NaCl溶液B.用干燥的广泛pH试纸测稀盐酸的pH=3.2C.用25 mL碱式滴定管量取16.60 mL高锰酸钾溶液D.用托盘天平称量时,将NaOH固体放在左盘内的滤纸上,称得质量为10.2 g11.绿色化学”又称环境无公害化学。下列叙述符合“绿色化学”原则的是( )A.绿色化学的核心是利用化学原理对工业生产造成的环境污染进行治理B.用聚苯乙烯等塑料代替木材生产包装盒、快餐盒等,以减少木材使用C.研制新型杀虫剂,使它只对目标昆虫有毒杀作用而对其他昆虫无害D.现代石油化工采用银作催化剂,将乙烯直接氧化生产环氧乙烷符合“原子经济”12.有机物种类繁多的主要原因是()A.自然界中存在着多种形式的、大量的有机物B.碳原子能与其它原子形成四个共价键,且碳原子间也相互成键(4)加入试剂①后,分离得到Mg(OH)2沉淀的方法是__________。试剂②可以选用_______。(5)反应①、反应②、反应③属于氧化还原反应类型的是________。(6)工业上常用电解熔融MgCl2的方法冶炼得到金属Mg,写出该反应的化学方程式__________。
(6分)镁及其合金是一种用途广泛的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
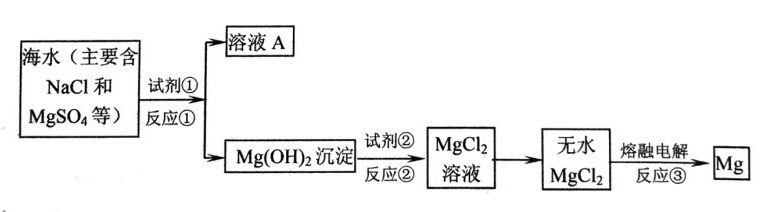
(1)镁在元素周期表中位于第__________周期,第___________族。
(2)为使MgSO4完全转化为Mg(OH)2沉淀,试剂①可选用____________(填化学式),且加入试剂①的量应______________(选填“少量”或“过量”)。
(3)若要检验溶液A中含有的SO42-,使用的试剂是_________________。
A.④>③=②>① B.④③>④ D.④>③>②>①
7.下列有关糖类、油脂、蛋白质的说法中,不正确的是( )
A.灼烧蚕丝织物有烧焦羽毛的气味
B.蔗糖和麦芽糖互为同分异构体
C.蔗糖溶液中加入稀硫酸,水解后加入银氨溶液,水浴加热未出现银镜,说明水解的产物为非还原性糖
D.利用油脂在碱性条件下的水解,可以制肥皂
8.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
9.下列反应的离子方程式书写正确的是
A.氯化铝溶液中加入过量氨水:A13++4NH3·H2O=AlO2-+ 4NH4++2H2O
B.澄清石灰水与过量碳酸氢钠溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.氯化亚铁溶液中通入氯气:2Fe2++C12=2Fe3++2C1-
10.下列实验操作和数据记录都正确的是( )
A.用10mL量筒量取9.2 mL NaCl溶液
B.用干燥的广泛pH试纸测稀盐酸的pH=3.2
C.用25 mL碱式滴定管量取16.60 mL高锰酸钾溶液
D.用托盘天平称量时,将NaOH固体放在左盘内的滤纸上,称得质量为10.2 g
11.绿色化学”又称环境无公害化学。下列叙述符合“绿色化学”原则的是( )
A.绿色化学的核心是利用化学原理对工业生产造成的环境污染进行治理
B.用聚苯乙烯等塑料代替木材生产包装盒、快餐盒等,以减少木材使用
C.研制新型杀虫剂,使它只对目标昆虫有毒杀作用而对其他昆虫无害
D.现代石油化工采用银作催化剂,将乙烯直接氧化生产环氧乙烷符合“原子经济”
12.有机物种类繁多的主要原因是()
A.自然界中存在着多种形式的、大量的有机物
B.碳原子能与其它原子形成四个共价键,且碳原子间也相互成键
(4)加入试剂①后,分离得到Mg(OH)2沉淀的方法是__________。试剂②可以选用_______。
(5)反应①、反应②、反应③属于氧化还原反应类型的是________。
(6)工业上常用电解熔融MgCl2的方法冶炼得到金属Mg,写出该反应的化学方程式__________。
题目解答
答案
三 ⅡA Ca(OH)2(或NaOH等合理答案均可) 过量 稀盐酸、氯化钡溶液 过滤 HCl(或盐酸) ③ MgCl2(熔融)  Mg + Cl2↑
Mg + Cl2↑
解析
镁的原子序数为12,位于第三周期,第IIA族。
步骤 2:选择试剂①
为了使MgSO4完全转化为Mg(OH)2沉淀,可以使用Ca(OH)2或NaOH等碱性试剂,且加入的量应过量以确保完全反应。
步骤 3:检验溶液A中含有的SO42-
检验SO42-离子,可以使用稀盐酸和氯化钡溶液。先加入稀盐酸酸化,再加入氯化钡溶液,若出现白色沉淀,则证明含有SO42-。
步骤 4:分离Mg(OH)2沉淀
加入试剂①后,通过过滤的方法分离得到Mg(OH)2沉淀。试剂②可以选用HCl(盐酸)来溶解Mg(OH)2。
步骤 5:确定氧化还原反应
反应①、反应②、反应③中,只有反应③是氧化还原反应,即电解熔融MgCl2。
步骤 6:写出电解熔融MgCl2的化学方程式
电解熔融MgCl2的化学方程式为:MgCl2(熔融) 通电 Mg + Cl2↑。