题目
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。高铁酸钾(K 2FeO 4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。湿法、干法制备高铁酸盐的原理如下所示。 干法:Fe 2O 3、KNO 3、KOH混合加热共熔生成紫红色高铁酸盐和KNO 2等产物 湿法:强碱性介质中,Fe(NO 3) 3与NaClO反应生成紫红色高铁酸盐溶液 工业上用湿法制备高铁酸钾的基本流程如下图所示: Fe(NO3)3-|||-il^2 饱和KOH-|||-NaOH溶液 氧化 调节pH 转化 分离 粗K2FeO4 提纯,K2FeO4-|||-沉淀-|||-反应① 反应③-|||-反应② 废液 (1)高铁酸钾在处理水的过程中所起的作用有 。 (2)“氧化”过程中发生反应的离子反应方程式为 。 (3)沉淀过程中加入浓KOH溶液的作用是: 。 (4)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。 图1为不同的温度下,Fe(NO 3) 3不同质量浓度对K 2FeO 4生成率的影响; 图2为一定温度下,Fe(NO 3) 3质量浓度最佳时,NaClO浓度对K 2FeO 4生成率的影响。 Fe(NO3)3-|||-il^2 饱和KOH-|||-NaOH溶液 氧化 调节pH 转化 分离 粗K2FeO4 提纯,K2FeO4-|||-沉淀-|||-反应① 反应③-|||-反应② 废液 工业生产中最佳温度为 ℃,此时Fe(NO 3) 3与NaClO两种溶液最佳质量浓度之比为 。 (5)K 2FeO 4在水溶液中易“水解”:4FeO 4 2- + 10H 2O Fe(NO3)3-|||-il^2 饱和KOH-|||-NaOH溶液 氧化 调节pH 转化 分离 粗K2FeO4 提纯,K2FeO4-|||-沉淀-|||-反应① 反应③-|||-反应② 废液4Fe(OH) 3 + 8OH - + 3O 2。在“提纯”K 2FeO 4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。 a.H 2O b.KOH、异丙醇 c.NH 4Cl、异丙醇 d.Fe(NO 3) 3、异丙醇 (6)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K 2FeO 4+8H 2O Fe(NO3)3-|||-il^2 饱和KOH-|||-NaOH溶液 氧化 调节pH 转化 分离 粗K2FeO4 提纯,K2FeO4-|||-沉淀-|||-反应① 反应③-|||-反应② 废液3Zn(OH) 2+Fe(OH) 3+4KOH,下列叙述正确的是 A.放电时FeO42-向正极移动 B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O C.放电时每转移3mol电子,正极有1molK2FeO4被氧化 D.充电时溶液的碱性减弱
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。高铁酸钾(K
2FeO
4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。湿法、干法制备高铁酸盐的原理如下所示。
干法:Fe 2O 3、KNO 3、KOH混合加热共熔生成紫红色高铁酸盐和KNO 2等产物
湿法:强碱性介质中,Fe(NO 3) 3与NaClO反应生成紫红色高铁酸盐溶液
工业上用湿法制备高铁酸钾的基本流程如下图所示:
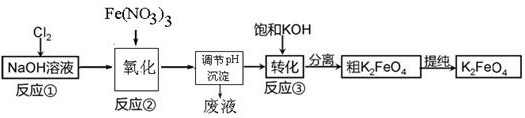
(1)高铁酸钾在处理水的过程中所起的作用有 。
(2)“氧化”过程中发生反应的离子反应方程式为 。
(3)沉淀过程中加入浓KOH溶液的作用是: 。
(4)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图1为不同的温度下,Fe(NO 3) 3不同质量浓度对K 2FeO 4生成率的影响;
图2为一定温度下,Fe(NO 3) 3质量浓度最佳时,NaClO浓度对K 2FeO 4生成率的影响。
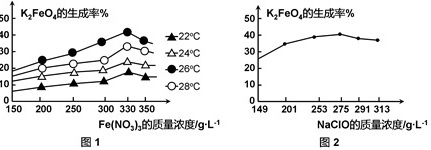
工业生产中最佳温度为 ℃,此时Fe(NO 3) 3与NaClO两种溶液最佳质量浓度之比为 。
(5)K 2FeO 4在水溶液中易“水解”:4FeO 4 2- + 10H 2O 4Fe(OH)
3 + 8OH
- + 3O
2。在“提纯”K
2FeO
4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
溶液(填序号)。
4Fe(OH)
3 + 8OH
- + 3O
2。在“提纯”K
2FeO
4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
溶液(填序号)。
a.H 2O b.KOH、异丙醇 c.NH 4Cl、异丙醇 d.Fe(NO 3) 3、异丙醇
(6)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K 2FeO 4+8H 2O 3Zn(OH)
2+Fe(OH)
3+4KOH,下列叙述正确的是
3Zn(OH)
2+Fe(OH)
3+4KOH,下列叙述正确的是
干法:Fe 2O 3、KNO 3、KOH混合加热共熔生成紫红色高铁酸盐和KNO 2等产物
湿法:强碱性介质中,Fe(NO 3) 3与NaClO反应生成紫红色高铁酸盐溶液
工业上用湿法制备高铁酸钾的基本流程如下图所示:

(1)高铁酸钾在处理水的过程中所起的作用有 。
(2)“氧化”过程中发生反应的离子反应方程式为 。
(3)沉淀过程中加入浓KOH溶液的作用是: 。
(4)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图1为不同的温度下,Fe(NO 3) 3不同质量浓度对K 2FeO 4生成率的影响;
图2为一定温度下,Fe(NO 3) 3质量浓度最佳时,NaClO浓度对K 2FeO 4生成率的影响。

工业生产中最佳温度为 ℃,此时Fe(NO 3) 3与NaClO两种溶液最佳质量浓度之比为 。
(5)K 2FeO 4在水溶液中易“水解”:4FeO 4 2- + 10H 2O
 4Fe(OH)
3 + 8OH
- + 3O
2。在“提纯”K
2FeO
4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
溶液(填序号)。
4Fe(OH)
3 + 8OH
- + 3O
2。在“提纯”K
2FeO
4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
溶液(填序号)。
a.H 2O b.KOH、异丙醇 c.NH 4Cl、异丙醇 d.Fe(NO 3) 3、异丙醇
(6)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K 2FeO 4+8H 2O
 3Zn(OH)
2+Fe(OH)
3+4KOH,下列叙述正确的是
3Zn(OH)
2+Fe(OH)
3+4KOH,下列叙述正确的是
| A.放电时FeO42-向正极移动 |
| B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
| C.放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D.充电时溶液的碱性减弱 |
题目解答
答案
(1)高铁酸钾具有强氧化性,能杀菌消毒;还原产物铁离子水解生成的氢氧化铁胶体,能凝聚水中的悬浮物,并能吸附色素,达到净水的目的(2分)
(2)2Fe 3+ + 3ClO - + 10OH - = 2FeO 4 2- + 3Cl - +5H 2O(2分)
(3)增大K +浓度,促进K 2FeO 4晶体析出(2分)
(4)26(2分); 6:5(2分) (5)b(2分) (6)BD(2分)
(2)2Fe 3+ + 3ClO - + 10OH - = 2FeO 4 2- + 3Cl - +5H 2O(2分)
(3)增大K +浓度,促进K 2FeO 4晶体析出(2分)
(4)26(2分); 6:5(2分) (5)b(2分) (6)BD(2分)
解析
步骤 1:分析高铁酸钾的作用
高铁酸钾(K _2FeO _4)是一种新型、高效、多功能水处理剂,具有强氧化性,能杀菌消毒;还原产物铁离子水解生成的氢氧化铁胶体,能凝聚水中的悬浮物,并能吸附色素,达到净水的目的。
步骤 2:写出氧化过程的离子方程式
在强碱性介质中,Fe(NO _3) _3与NaClO反应生成高铁酸盐,反应的离子方程式为:2Fe ^{3+ }+ 3ClO ^{-} + 10OH ^{- }= 2FeO _4 ^{2- }+ 3Cl ^{- }+5H _2O。
步骤 3:分析沉淀过程中加入浓KOH溶液的作用
沉淀过程中加入浓KOH溶液,可以增大K ^{+}浓度,促进K _2FeO _4晶体析出。
步骤 4:确定最佳温度和最佳质量浓度之比
根据图1和图2,工业生产中最佳温度为26℃,此时Fe(NO _3) _3与NaClO两种溶液最佳质量浓度之比为6:5。
步骤 5:选择洗涤剂
K _2FeO _4在水溶液中易“水解”,在“提纯”K _2FeO _4中采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用KOH、异丙醇溶液,以减少水解。
步骤 6:分析高铁电池的总反应
高铁电池的总反应为:3Zn+2K _2FeO _4+8H _2O 3Zn(OH) _2+Fe(OH) _3+4KOH,放电时FeO_4^{2-}向负极移动,充电时阳极反应为:Fe(OH)_3-3e^{-}+5OH^{-}=FeO_4^{2-}+4H_2O,放电时每转移3mol电子,正极有1molK_2FeO_4被还原,充电时溶液的碱性增强。
高铁酸钾(K _2FeO _4)是一种新型、高效、多功能水处理剂,具有强氧化性,能杀菌消毒;还原产物铁离子水解生成的氢氧化铁胶体,能凝聚水中的悬浮物,并能吸附色素,达到净水的目的。
步骤 2:写出氧化过程的离子方程式
在强碱性介质中,Fe(NO _3) _3与NaClO反应生成高铁酸盐,反应的离子方程式为:2Fe ^{3+ }+ 3ClO ^{-} + 10OH ^{- }= 2FeO _4 ^{2- }+ 3Cl ^{- }+5H _2O。
步骤 3:分析沉淀过程中加入浓KOH溶液的作用
沉淀过程中加入浓KOH溶液,可以增大K ^{+}浓度,促进K _2FeO _4晶体析出。
步骤 4:确定最佳温度和最佳质量浓度之比
根据图1和图2,工业生产中最佳温度为26℃,此时Fe(NO _3) _3与NaClO两种溶液最佳质量浓度之比为6:5。
步骤 5:选择洗涤剂
K _2FeO _4在水溶液中易“水解”,在“提纯”K _2FeO _4中采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用KOH、异丙醇溶液,以减少水解。
步骤 6:分析高铁电池的总反应
高铁电池的总反应为:3Zn+2K _2FeO _4+8H _2O 3Zn(OH) _2+Fe(OH) _3+4KOH,放电时FeO_4^{2-}向负极移动,充电时阳极反应为:Fe(OH)_3-3e^{-}+5OH^{-}=FeO_4^{2-}+4H_2O,放电时每转移3mol电子,正极有1molK_2FeO_4被还原,充电时溶液的碱性增强。