题目
在298K,100 kPa下,1mol过冷水蒸汽变为298K,100 kPa的液态水,求此过程的ΔS和ΔG。已知298K水的饱和蒸汽压为3.1674 kPa,汽化热为2217 kJ/kg。上述过程能否自发进行?
在298K,100 kPa下,1mol过冷水蒸汽变为298K,100 kPa的液态水,求此过程的ΔS和ΔG。已知298K水的饱和蒸汽压为3.1674 kPa,汽化热为2217 kJ/kg。上述过程能否自发进行?
题目解答
答案
解:
整个过程为等温变化过程,则:
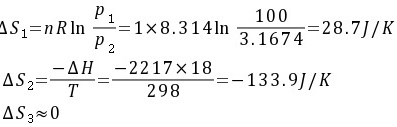
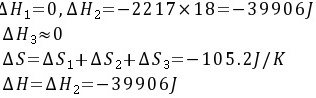

解析
步骤 1:计算过冷水蒸汽变为液态水的熵变
在等温条件下,熵变可以通过以下公式计算:
${S}_{1}=nR\ln \dfrac {{P}_{1}}{{P}_{2}}$
其中,$n$为物质的量,$R$为理想气体常数,${P}_{1}$为初始压力,${P}_{2}$为最终压力。
步骤 2:计算过冷水蒸汽变为液态水的焓变
在等温条件下,焓变可以通过以下公式计算:
$\Delta {S}_{2}=\dfrac {-\Delta H}{T}$
其中,$\Delta H$为汽化热,$T$为温度。
步骤 3:计算过冷水蒸汽变为液态水的吉布斯自由能变
吉布斯自由能变可以通过以下公式计算:
$\Delta G=\Delta H-T\Delta S$
其中,$\Delta H$为焓变,$\Delta S$为熵变,$T$为温度。
步骤 4:判断过程是否自发进行
如果$\Delta G$小于0,则过程为自发过程;如果$\Delta G$大于0,则过程为非自发过程。
在等温条件下,熵变可以通过以下公式计算:
${S}_{1}=nR\ln \dfrac {{P}_{1}}{{P}_{2}}$
其中,$n$为物质的量,$R$为理想气体常数,${P}_{1}$为初始压力,${P}_{2}$为最终压力。
步骤 2:计算过冷水蒸汽变为液态水的焓变
在等温条件下,焓变可以通过以下公式计算:
$\Delta {S}_{2}=\dfrac {-\Delta H}{T}$
其中,$\Delta H$为汽化热,$T$为温度。
步骤 3:计算过冷水蒸汽变为液态水的吉布斯自由能变
吉布斯自由能变可以通过以下公式计算:
$\Delta G=\Delta H-T\Delta S$
其中,$\Delta H$为焓变,$\Delta S$为熵变,$T$为温度。
步骤 4:判断过程是否自发进行
如果$\Delta G$小于0,则过程为自发过程;如果$\Delta G$大于0,则过程为非自发过程。