题目
(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:①该电池放电时正极的电极反应式为_____________________;若维持电流强度为1 A,电池工作十分钟,理论消耗Zn________g(已知F=96 500 C·mol-1)。②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向________(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向________(填“左”或“右”)移动。③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有_____________________________________________________________________________________________。(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,电池正极的电极反应式为____________________________,A是________。(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如下图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为_____________________________________________________________________________________。解析:(1)①放电时高铁酸钾为正极,正极发生还原反应,电极反应式为FeO+4H2O+3e-===Fe(OH)3↓+5OH-;若维持电流强度为1 A,电池工作十分钟,转移电子的物质的量为1×10×60÷96 500=0.006 217 6 mol。理论消耗Zn的质量0.006 217 6 mol÷2×65≈0.2 g(已知F=96 500 C·mol-1)。②电池工作时,阴离子移向负极,阳离子移向正极,所以盐桥中氯离子向右移动;若用阳离子交换膜代替盐桥,则钾离子向左移动。③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有使用时间长、工作电压稳定。(2)该电池的本质反应是合成氨反应,电池中氢气失去电子,在负极发生氧化反应,氮气得电子在正极发生还原反应,则正极反应式为N2+8H++6e-===2NH,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵溶液。(3)工作时电极b作正极,O2-由电极b移向电极a;该装置是原电池,通入一氧化碳的电极a是负极,负极上一氧化碳失去电子发生氧化反应,电极反应式为CO+O2--2e-===CO2。
(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
①该电池放电时正极的电极反应式为_____________________;
若维持电流强度为1 A,电池工作十分钟,理论消耗Zn________g(已知F=96 500 C·mol-1)。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向________(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向________(填“左”或“右”)移动。
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有________________________________________
_____________________________________________________。
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,电池正极的电极反应式为____________________________,A是________。
(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如下图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为_______________________________
______________________________________________________。
解析:(1)①放电时高铁酸钾为正极,正极发生还原反应,电极反应式为FeO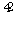 +4H2O+3e-===Fe(OH)3↓+5OH-;若维持电流强度为1 A,电池工作十分钟,转移电子的物质的量为1×10×60÷96 500=0.006 217 6 mol。理论消耗Zn的质量0.006 217 6 mol÷2×65≈0.2 g(已知F=96 500 C·mol-1)。
+4H2O+3e-===Fe(OH)3↓+5OH-;若维持电流强度为1 A,电池工作十分钟,转移电子的物质的量为1×10×60÷96 500=0.006 217 6 mol。理论消耗Zn的质量0.006 217 6 mol÷2×65≈0.2 g(已知F=96 500 C·mol-1)。
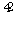 +4H2O+3e-===Fe(OH)3↓+5OH-;若维持电流强度为1 A,电池工作十分钟,转移电子的物质的量为1×10×60÷96 500=0.006 217 6 mol。理论消耗Zn的质量0.006 217 6 mol÷2×65≈0.2 g(已知F=96 500 C·mol-1)。
+4H2O+3e-===Fe(OH)3↓+5OH-;若维持电流强度为1 A,电池工作十分钟,转移电子的物质的量为1×10×60÷96 500=0.006 217 6 mol。理论消耗Zn的质量0.006 217 6 mol÷2×65≈0.2 g(已知F=96 500 C·mol-1)。②电池工作时,阴离子移向负极,阳离子移向正极,所以盐桥中氯离子向右移动;若用阳离子交换膜代替盐桥,则钾离子向左移动。
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有使用时间长、工作电压稳定。
(2)该电池的本质反应是合成氨反应,电池中氢气失去电子,在负极发生氧化反应,氮气得电子在正极发生还原反应,则正极反应式为N2+8H++6e-===2NH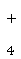 ,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵溶液。
,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵溶液。
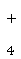 ,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵溶液。
,氨气与HCl反应生成氯化铵,则电解质溶液为氯化铵溶液。(3)工作时电极b作正极,O2-由电极b移向电极a;该装置是原电池,通入一氧化碳的电极a是负极,负极上一氧化碳失去电子发生氧化反应,电极反应式为CO+O2--2e-===CO2。
题目解答
答案
答案:(1)①FeO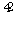 +4H2O+3e-===Fe(OH)3↓+5OH- 0.2 ②右 左 ③使用时间长、工作电压稳定
+4H2O+3e-===Fe(OH)3↓+5OH- 0.2 ②右 左 ③使用时间长、工作电压稳定
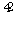 +4H2O+3e-===Fe(OH)3↓+5OH- 0.2 ②右 左 ③使用时间长、工作电压稳定
+4H2O+3e-===Fe(OH)3↓+5OH- 0.2 ②右 左 ③使用时间长、工作电压稳定(2)N2+8H++6e-===2NH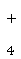 氯化铵 (3)从b到a CO+O2-2、-===CO2
氯化铵 (3)从b到a CO+O2-2、-===CO2
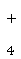 氯化铵 (3)从b到a CO+O2-2、-===CO2
氯化铵 (3)从b到a CO+O2-2、-===CO2