题目
2.[2023·辽宁卷]硫酸工业在国民经济中占有重-|||-要地位。-|||-(1)我国古籍记载了硫酸的制备方法-"炼石胆-|||-(CuSO4·5H2 O)取精华法"。借助现代仪器分析,-|||-该制备过程中CuSO 4·5H2O分解的TG曲线(热-|||-重)及DSC曲线(反映体系热量变化情况,数值已省-|||-略)如下图所示。700 ℃左右有两个吸热峰,则此时-|||-分解生成的氧化物有SO2、 __ 和 __ (填-|||-化学式)。2.[2023·辽宁卷]硫酸工业在国民经济中占有重-|||-要地位。-|||-(1)我国古籍记载了硫酸的制备方法-"炼石胆-|||-(CuSO4·5H2 O)取精华法"。借助现代仪器分析,-|||-该制备过程中CuSO 4·5H2O分解的TG曲线(热-|||-重)及DSC曲线(反映体系热量变化情况,数值已省-|||-略)如下图所示。700 ℃左右有两个吸热峰,则此时-|||-分解生成的氧化物有SO2、 __ 和 __ (填-|||-化学式)。2.[2023·辽宁卷]硫酸工业在国民经济中占有重-|||-要地位。-|||-(1)我国古籍记载了硫酸的制备方法-"炼石胆-|||-(CuSO4·5H2 O)取精华法"。借助现代仪器分析,-|||-该制备过程中CuSO 4·5H2O分解的TG曲线(热-|||-重)及DSC曲线(反映体系热量变化情况,数值已省-|||-略)如下图所示。700 ℃左右有两个吸热峰,则此时-|||-分解生成的氧化物有SO2、 __ 和 __ (填-|||-化学式)。


题目解答
答案

解析
步骤 1:分析CuSO4·5H2O分解的TG曲线和DSC曲线
根据TG曲线和DSC曲线,700 ℃左右有两个吸热峰,说明CuSO4·5H2O在700 ℃左右分解生成了SO2、CuO和SO3。
步骤 2:分析NO2在反应中的作用
在反应$N{O}_{2}+S{O}_{2}+{H}_{2}O=\!=\!= NO+{H}_{2}S{O}_{4}$中,NO2作为氧化剂,将SO2氧化为H2SO4,同时自身被还原为NO。在反应$2NO+{O}_{2}=\!=\!= 2N{O}_{2}$中,NO被氧化为NO2。因此,NO2在整个过程中起到了催化剂的作用。
步骤 3:分析铅室法和接触法的优缺点
铅室法反应中有NO和NO2放出,污染空气;副产物亚硝基硫酸影响产品质量;铅室法制硫酸的产率不高;制得硫酸浓度相对较低。接触法可以避免这些缺点,因此被广泛采用。
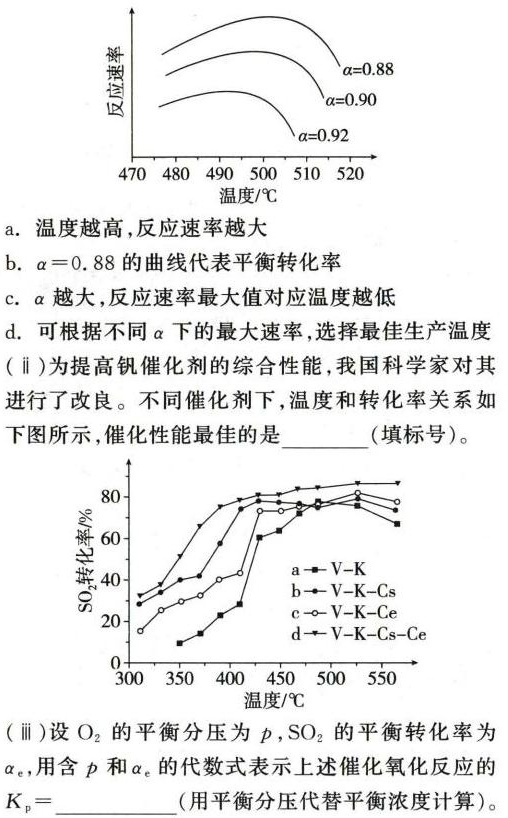
步骤 4:分析不同转化率下反应速率与温度的关系
根据图示,温度越高,反应速率越大,但α=0.88的曲线不代表平衡转化率,α越大,反应速率最大值对应温度越低,可根据不同α下的最大速率,选择最佳生产温度。
步骤 5:分析不同催化剂下温度和转化率的关系
根据图示,催化性能最佳的是d,即-V-K-Cs-Ce。
步骤 6:计算催化氧化反应的${K}_{p}$
设O2的平衡分压为p,SO2的平衡转化率为α。,则${K}_{p}=\dfrac {{\alpha }_{0}}{(1-\alpha )\cdot {p}^{\dfrac {1}{2}}}$。
根据TG曲线和DSC曲线,700 ℃左右有两个吸热峰,说明CuSO4·5H2O在700 ℃左右分解生成了SO2、CuO和SO3。
步骤 2:分析NO2在反应中的作用
在反应$N{O}_{2}+S{O}_{2}+{H}_{2}O=\!=\!= NO+{H}_{2}S{O}_{4}$中,NO2作为氧化剂,将SO2氧化为H2SO4,同时自身被还原为NO。在反应$2NO+{O}_{2}=\!=\!= 2N{O}_{2}$中,NO被氧化为NO2。因此,NO2在整个过程中起到了催化剂的作用。
步骤 3:分析铅室法和接触法的优缺点
铅室法反应中有NO和NO2放出,污染空气;副产物亚硝基硫酸影响产品质量;铅室法制硫酸的产率不高;制得硫酸浓度相对较低。接触法可以避免这些缺点,因此被广泛采用。
步骤 4:分析不同转化率下反应速率与温度的关系
根据图示,温度越高,反应速率越大,但α=0.88的曲线不代表平衡转化率,α越大,反应速率最大值对应温度越低,可根据不同α下的最大速率,选择最佳生产温度。
步骤 5:分析不同催化剂下温度和转化率的关系
根据图示,催化性能最佳的是d,即-V-K-Cs-Ce。
步骤 6:计算催化氧化反应的${K}_{p}$
设O2的平衡分压为p,SO2的平衡转化率为α。,则${K}_{p}=\dfrac {{\alpha }_{0}}{(1-\alpha )\cdot {p}^{\dfrac {1}{2}}}$。