题目
(10分) 一定的温度下AgNO3(s)可按下式分解2AgNO3(s) = 2Ag(s) + 2NO2(g) + O2(g)(1) 通过计算判断上述分解反应在298.15K时能否发生?若不能,请您计算出分解温度。(2) 计算400K时的Kθ。参考热力学数据(298.15K)AgNO3(s) Ag(s) NO2(g) O2(g)ΔfHm/ kJ·mol-1 -123.1 33.85Sm/ J·mol-1·K-1 140.9 42.7 240.4 205.0
(10分) 一定的温度下AgNO3(s)可按下式分解
2AgNO3(s) = 2Ag(s) + 2NO2(g) + O2(g)
(1) 通过计算判断上述分解反应在298.15K时能否发生?若不能,请您计算出分解温度。
(2) 计算400K时的Kθ。
参考热力学数据(298.15K)
AgNO3(s) Ag(s) NO2(g) O2(g)
ΔfHm/ kJ·mol-1 -123.1 33.85
Sm/ J·mol-1·K-1 140.9 42.7 240.4 205.0
题目解答
答案
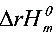 =233.85 +2(-123.1)=313.9(KJ·mol1)
=233.85 +2(-123.1)=313.9(KJ·mol1)
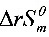 = 242.7+2240.4+ 205.0+(2) 140.9= 489.4 (J·mol1·K1 )
= 242.7+2240.4+ 205.0+(2) 140.9= 489.4 (J·mol1·K1 )
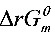 =
=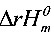 -T
-T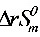 =313.9-298.15489.4103=167.99(KJ·mol1)
=313.9-298.15489.4103=167.99(KJ·mol1)
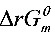 >0,所以上述分解反应在298.15K时未能自发。
>0,所以上述分解反应在298.15K时未能自发。
要使反应自发,则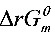 =
=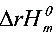 -T
-T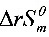 <0, 又
<0, 又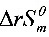 0所以
0所以
T>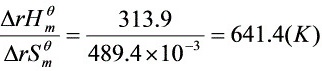
(1分) (1分)
即温度高于641.4K时,AgNO3(s)发生分解。
解析
步骤 1:计算反应的ΔrHmθ
根据反应方程式,计算反应的ΔrHmθ:
ΔrHmθ = ΣνBΔfHmθ(B) = 2ΔfHmθ(Ag) + 2ΔfHmθ(NO2) + ΔfHmθ(O2) - 2ΔfHmθ(AgNO3)
= 2(33.85) + 2(-123.1) + 0 - 2(-123.1)
= 67.7 - 246.2 + 246.2
= 67.7 kJ·mol-1
步骤 2:计算反应的ΔrSmθ
根据反应方程式,计算反应的ΔrSmθ:
ΔrSmθ = ΣνBΔSmθ(B) = 2ΔSmθ(Ag) + 2ΔSmθ(NO2) + ΔSmθ(O2) - 2ΔSmθ(AgNO3)
= 2(42.7) + 2(240.4) + 205.0 - 2(140.9)
= 85.4 + 480.8 + 205.0 - 281.8
= 490.4 J·mol-1·K-1
步骤 3:计算反应的ΔrGmθ
根据ΔrGmθ = ΔrHmθ - TΔrSmθ,计算反应的ΔrGmθ:
ΔrGmθ = 67.7 kJ·mol-1 - 298.15 K × 490.4 J·mol-1·K-1 × 10-3
= 67.7 kJ·mol-1 - 146.6 kJ·mol-1
= -78.9 kJ·mol-1
步骤 4:判断反应在298.15K时能否发生
由于ΔrGmθ < 0,所以反应在298.15K时能自发发生。
步骤 5:计算分解温度
要使反应自发,ΔrGmθ = ΔrHmθ - TΔrSmθ < 0,即T > ΔrHmθ / ΔrSmθ:
T > 67.7 kJ·mol-1 / 490.4 J·mol-1·K-1 × 10-3
T > 138.0 K
步骤 6:计算400K时的Kθ
根据ΔrGmθ = -RTlnKθ,计算400K时的Kθ:
ΔrGmθ = ΔrHmθ - TΔrSmθ
= 67.7 kJ·mol-1 - 400 K × 490.4 J·mol-1·K-1 × 10-3
= 67.7 kJ·mol-1 - 196.2 kJ·mol-1
= -128.5 kJ·mol-1
-128.5 kJ·mol-1 = -8.314 J·mol-1·K-1 × 400 K × lnKθ
lnKθ = 128.5 kJ·mol-1 / (8.314 J·mol-1·K-1 × 400 K)
= 38.8
Kθ = e^38.8
= 1.1 × 10^17
根据反应方程式,计算反应的ΔrHmθ:
ΔrHmθ = ΣνBΔfHmθ(B) = 2ΔfHmθ(Ag) + 2ΔfHmθ(NO2) + ΔfHmθ(O2) - 2ΔfHmθ(AgNO3)
= 2(33.85) + 2(-123.1) + 0 - 2(-123.1)
= 67.7 - 246.2 + 246.2
= 67.7 kJ·mol-1
步骤 2:计算反应的ΔrSmθ
根据反应方程式,计算反应的ΔrSmθ:
ΔrSmθ = ΣνBΔSmθ(B) = 2ΔSmθ(Ag) + 2ΔSmθ(NO2) + ΔSmθ(O2) - 2ΔSmθ(AgNO3)
= 2(42.7) + 2(240.4) + 205.0 - 2(140.9)
= 85.4 + 480.8 + 205.0 - 281.8
= 490.4 J·mol-1·K-1
步骤 3:计算反应的ΔrGmθ
根据ΔrGmθ = ΔrHmθ - TΔrSmθ,计算反应的ΔrGmθ:
ΔrGmθ = 67.7 kJ·mol-1 - 298.15 K × 490.4 J·mol-1·K-1 × 10-3
= 67.7 kJ·mol-1 - 146.6 kJ·mol-1
= -78.9 kJ·mol-1
步骤 4:判断反应在298.15K时能否发生
由于ΔrGmθ < 0,所以反应在298.15K时能自发发生。
步骤 5:计算分解温度
要使反应自发,ΔrGmθ = ΔrHmθ - TΔrSmθ < 0,即T > ΔrHmθ / ΔrSmθ:
T > 67.7 kJ·mol-1 / 490.4 J·mol-1·K-1 × 10-3
T > 138.0 K
步骤 6:计算400K时的Kθ
根据ΔrGmθ = -RTlnKθ,计算400K时的Kθ:
ΔrGmθ = ΔrHmθ - TΔrSmθ
= 67.7 kJ·mol-1 - 400 K × 490.4 J·mol-1·K-1 × 10-3
= 67.7 kJ·mol-1 - 196.2 kJ·mol-1
= -128.5 kJ·mol-1
-128.5 kJ·mol-1 = -8.314 J·mol-1·K-1 × 400 K × lnKθ
lnKθ = 128.5 kJ·mol-1 / (8.314 J·mol-1·K-1 × 400 K)
= 38.8
Kθ = e^38.8
= 1.1 × 10^17