题目
2023新变化:某化学兴趣小组对金属和酸的反应进行了探究。【实验1】利用以下试剂,对影响化学反应速率的因素开展探究活动。提供的试剂:6%稀盐酸、10%稀盐酸、铝粉、铁粉、铁片。【提出问题】影响化学反应速率的因素有哪些?【猜想与假设】(1)猜想1:物质的性质;猜想2:反应的温度;猜想3:反应物之间的接触面积;猜想4: ____ 。【实验探究】(2)为验证猜想3,同学们利用压强传感器采用如图甲实验装置进行实验,测得的数据整理成图像后如图乙所示。完成该实验需要选用的药品是 ____ ;写出发生反应的化学方程式 ____ 。传感器 采集信息-|||-形成图像-|||-稀盐酸-|||-5mL10%-|||-↑气压-|||-a A-|||-a:b B-|||-0 时间-|||-乙(3)请你设计实验验证猜想4: ____ 。【实验2】同学们查阅资料发现工业上常用铁罐车运输浓硫酸,为探究铁能否与浓硫酸反应,取一打磨过的铁片先放入浓硫酸中,一段时间后将铁片取出,用水冲洗干净后,放入硫酸铜溶液中,观察铁片表面没有明显现象。(4)常温下铁 ____ (选填“能”或“不能”)与浓硫酸反应。(5)运输浓硫酸的铁罐车能否用水冲洗?请回答并分析原因 ____ 。【拓展应用】(6)在做金属与酸反应、金属与盐溶液反应的实验前,要打磨金属,其目的是 ____ 。
2023新变化:某化学兴趣小组对金属和酸的反应进行了探究。
【实验1】利用以下试剂,对影响化学反应速率的因素开展探究活动。
提供的试剂:6%稀盐酸、10%稀盐酸、铝粉、铁粉、铁片。
【提出问题】影响化学反应速率的因素有哪些?
【猜想与假设】
(1)猜想1:物质的性质;猜想2:反应的温度;猜想3:反应物之间的接触面积;猜想4: ____ 。
【实验探究】
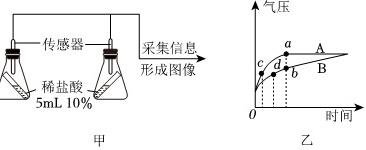
(2)为验证猜想3,同学们利用压强传感器采用如图甲实验装置进行实验,测得的数据整理成图像后如图乙所示。完成该实验需要选用的药品是 ____ ;写出发生反应的化学方程式 ____ 。
(3)请你设计实验验证猜想4: ____ 。
【实验2】同学们查阅资料发现工业上常用铁罐车运输浓硫酸,为探究铁能否与浓硫酸反应,取一打磨过的铁片先放入浓硫酸中,一段时间后将铁片取出,用水冲洗干净后,放入硫酸铜溶液中,观察铁片表面没有明显现象。
(4)常温下铁 ____ (选填“能”或“不能”)与浓硫酸反应。
(5)运输浓硫酸的铁罐车能否用水冲洗?请回答并分析原因 ____ 。
【拓展应用】
(6)在做金属与酸反应、金属与盐溶液反应的实验前,要打磨金属,其目的是 ____ 。
【实验1】利用以下试剂,对影响化学反应速率的因素开展探究活动。
提供的试剂:6%稀盐酸、10%稀盐酸、铝粉、铁粉、铁片。
【提出问题】影响化学反应速率的因素有哪些?
【猜想与假设】
(1)猜想1:物质的性质;猜想2:反应的温度;猜想3:反应物之间的接触面积;猜想4: ____ 。
【实验探究】
(2)为验证猜想3,同学们利用压强传感器采用如图甲实验装置进行实验,测得的数据整理成图像后如图乙所示。完成该实验需要选用的药品是 ____ ;写出发生反应的化学方程式 ____ 。

(3)请你设计实验验证猜想4: ____ 。
【实验2】同学们查阅资料发现工业上常用铁罐车运输浓硫酸,为探究铁能否与浓硫酸反应,取一打磨过的铁片先放入浓硫酸中,一段时间后将铁片取出,用水冲洗干净后,放入硫酸铜溶液中,观察铁片表面没有明显现象。
(4)常温下铁 ____ (选填“能”或“不能”)与浓硫酸反应。
(5)运输浓硫酸的铁罐车能否用水冲洗?请回答并分析原因 ____ 。
【拓展应用】
(6)在做金属与酸反应、金属与盐溶液反应的实验前,要打磨金属,其目的是 ____ 。
题目解答
答案
解:(1)由提供的试剂及猜想1~3可知,影响化学反应速率的因素还有反应物的浓度,即为猜想4。
(2)①为验证反应物之间的接触面积影响化学反应速率,需要设计对比实验,题图中已选用10%稀盐酸,则还需要选用的药品是等质量的铁粉和铁片;
②铁与稀盐酸反应生成氯化亚铁和氢气,化学方程式为:Fe+2HCl=FeCl2+H2↑;
(3)验证猜想4即反应物的浓度会影响化学反应速率,可设计如下实验:取等质量、表面积相同的铁片分别装入两支试管中,分别加入等量的6%稀盐酸、10%稀盐酸,观察产生气泡的剧烈程度;
(4)铁与硫酸铜溶液反应,会观察到铁片表面有红色固体析出,由【实验2】现象可知,加入硫酸铜溶液的铁片表面没有明显现象,说明没有发生铁与硫酸铜的反应,铁片表面有其他物质阻止反应,从而证明铁与浓硫酸发生反应生成了新物质;
(5)运输浓硫酸的铁罐车不能用水冲洗,是因为用水冲洗后,浓硫酸变稀,铁和稀硫酸不断反应,导致铁罐车被腐蚀;
(6)在做金属与酸反应、金属与盐溶液反应的实验前,要打磨金属,其目的是除去金属表面的氧化膜。
故答案为:(1)反应物的浓度。
(2)等质量的铁粉和铁片;Fe+2HCl=FeCl2+H2↑。
(3)取等质量、表面积相同的铁片分别装入两支试管中,分别加入等量的6%稀盐酸、10%稀盐酸,观察产生气泡的剧烈程度。
(4)能。
(5)不能用水冲洗,因为用水冲洗后,浓硫酸变稀,铁和稀硫酸不断反应,导致铁罐车被腐蚀。
(6)除去金属表面的氧化膜。
(2)①为验证反应物之间的接触面积影响化学反应速率,需要设计对比实验,题图中已选用10%稀盐酸,则还需要选用的药品是等质量的铁粉和铁片;
②铁与稀盐酸反应生成氯化亚铁和氢气,化学方程式为:Fe+2HCl=FeCl2+H2↑;
(3)验证猜想4即反应物的浓度会影响化学反应速率,可设计如下实验:取等质量、表面积相同的铁片分别装入两支试管中,分别加入等量的6%稀盐酸、10%稀盐酸,观察产生气泡的剧烈程度;
(4)铁与硫酸铜溶液反应,会观察到铁片表面有红色固体析出,由【实验2】现象可知,加入硫酸铜溶液的铁片表面没有明显现象,说明没有发生铁与硫酸铜的反应,铁片表面有其他物质阻止反应,从而证明铁与浓硫酸发生反应生成了新物质;
(5)运输浓硫酸的铁罐车不能用水冲洗,是因为用水冲洗后,浓硫酸变稀,铁和稀硫酸不断反应,导致铁罐车被腐蚀;
(6)在做金属与酸反应、金属与盐溶液反应的实验前,要打磨金属,其目的是除去金属表面的氧化膜。
故答案为:(1)反应物的浓度。
(2)等质量的铁粉和铁片;Fe+2HCl=FeCl2+H2↑。
(3)取等质量、表面积相同的铁片分别装入两支试管中,分别加入等量的6%稀盐酸、10%稀盐酸,观察产生气泡的剧烈程度。
(4)能。
(5)不能用水冲洗,因为用水冲洗后,浓硫酸变稀,铁和稀硫酸不断反应,导致铁罐车被腐蚀。
(6)除去金属表面的氧化膜。
解析
考查要点:本题主要考查影响化学反应速率的因素(如浓度、接触面积、温度等)及金属与酸反应的实验设计,同时涉及浓硫酸与铁的钝化现象及实际应用分析。
解题核心思路:
- 猜想补充:根据提供的试剂(不同浓度盐酸、不同形态金属),结合已知猜想,补充猜想4为反应物的浓度。
- 实验设计:验证猜想3(接触面积)需控制变量,选择相同质量但不同形态的金属(如铁粉和铁片);验证猜想4(浓度)需设计不同浓度盐酸与相同金属反应。
- 现象分析:铁片表面无现象说明未发生置换反应,结合浓硫酸钝化铁的性质,推断铁与浓硫酸反应生成致密氧化膜。
- 实际应用:浓硫酸稀释后会与铁反应,因此铁罐车不能用水冲洗。
(1)猜想4的补充
关键点:题目提供的试剂包含不同浓度的盐酸(6%和10%),而前三个猜想已涉及物质性质、温度、接触面积,因此猜想4应为反应物的浓度。
(2)验证猜想3的实验设计
选择药品
需保持其他条件相同,仅改变反应物接触面积,因此选择等质量的铁粉和铁片,配合10%稀盐酸。
反应方程式
铁与稀盐酸反应生成氯化亚铁和氢气:
$\text{Fe} + 2\text{HCl} \rightarrow \text{FeCl}_2 + \text{H}_2↑$
(3)验证猜想4的实验设计
关键点:需控制金属表面积、质量相同,仅改变盐酸浓度。
步骤:取等质量、表面积相同的铁片,分别加入等量6%和10%稀盐酸,观察气泡产生速度。
(4)铁与浓硫酸的反应判断
现象分析:铁片表面未析出红色固体,说明未与硫酸铜反应,推测铁表面被浓硫酸钝化生成致密氧化膜,因此铁能与浓硫酸反应。
(5)铁罐车冲洗分析
关键结论:用水冲洗会使浓硫酸稀释,稀硫酸与铁反应导致铁罐车腐蚀,因此不能用水冲洗。
(6)打磨金属的目的
基本操作:去除金属表面的氧化膜,确保反应直接在金属与酸/盐溶液之间进行。