题目
, l4 t0 t2对碳硫及其化合物的研究有重要的意义. I.利用水煤气合成二甲醚(CH3OCH3)的三步反应如下: ①2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ.mol-1②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ.mol-1③CO(g)+H2O(g)═CO2+H2(g)△H=-41.3kJ.mol-1写出利用水煤气合成二甲醚(CH3OCH3) 的热化学方程式: ______ . Ⅱ.工业制硫酸的过程中利用反应2SO2(g)+O2(g), l4 t0 t2SO3(g)△H=-196.6kJ•mol-1,将SO2转化为SO3,尾气SO3可用NaOH溶液进行吸收.请回答下列问题: (1)写出该反应的化学平衡常数表达式: ______ . (2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,下列说法中正确的是 ______ (填字母). A.若反应速率v正(O2)=2v逆(SO3),则可以说明该可逆反应已达到平衡状态 B.保持温度和容器体积不变,再充入2mol SO2和1mol O2,n(SO3)/n(SO2)增大 C.平衡后移动活塞压缩气体,达到平衡时SO2、O2的百分含量减小,SO3的百分含量增大 D.平衡后升高温度,平衡常数K增大 (3)将一定量的SO2(g)和O2(g)分别通入到容积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据: 实验编号 温度/℃ 起始量/mol 平衡量/mol 达到平衡所需时间/min SO2 O2 SO2 O2 1 T1 4 2 X 0.8 6 2 T2 4 2 0.4 Y t 实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为 ______ ;T1______ T2(选填“>”“<”或“=”),理由是 ______ (4)某SO2(g)和O2(g)反应体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示.若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是 ______ ;图中表示平衡混合物中SO2的转化率最高的一段时间是 ______ .
 对碳硫及其化合物的研究有重要的意义.
对碳硫及其化合物的研究有重要的意义.
I.利用水煤气合成二甲醚(CH3OCH3)的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ.mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ.mol-1
③CO(g)+H2O(g)═CO2+H2(g)△H=-41.3kJ.mol-1
写出利用水煤气合成二甲醚(CH3OCH3) 的热化学方程式: ______ .
Ⅱ.工业制硫酸的过程中利用反应2SO2(g)+O2(g)
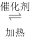 SO3(g)△H=-196.6kJ•mol-1,将SO2转化为SO3,尾气SO3可用NaOH溶液进行吸收.请回答下列问题:
SO3(g)△H=-196.6kJ•mol-1,将SO2转化为SO3,尾气SO3可用NaOH溶液进行吸收.请回答下列问题:
(1)写出该反应的化学平衡常数表达式: ______ .
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,下列说法中正确的是 ______ (填字母).
A.若反应速率v正(O2)=2v逆(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,再充入2mol SO2和1mol O2,n(SO3)/n(SO2)增大
C.平衡后移动活塞压缩气体,达到平衡时SO2、O2的百分含量减小,SO3的百分含量增大
D.平衡后升高温度,平衡常数K增大
(3)将一定量的SO2(g)和O2(g)分别通入到容积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | X | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | Y | t |
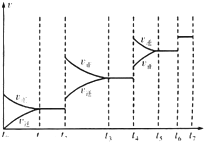
(4)某SO2(g)和O2(g)反应体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示.若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是 ______ ;图中表示平衡混合物中SO2的转化率最高的一段时间是 ______ .
题目解答
答案
3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol-1;K=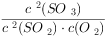 ;BC;0.2mol/L•min;>;反应放热,温度升高平衡向左移动,反应物转化率低;升高温度;t3~t4
;BC;0.2mol/L•min;>;反应放热,温度升高平衡向左移动,反应物转化率低;升高温度;t3~t4
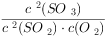 ;BC;0.2mol/L•min;>;反应放热,温度升高平衡向左移动,反应物转化率低;升高温度;t3~t4
;BC;0.2mol/L•min;>;反应放热,温度升高平衡向左移动,反应物转化率低;升高温度;t3~t4