题目
2. 当下列电池中的溶液是pH = 4.00的缓冲溶液时,在25℃测得电池的电动势为 0.209V: 玻璃电极│H+(α=X )‖SCE当缓冲溶液由未知溶液代替时,测得电池电动势如下:(a) 0.312V; (b) 0.088V (c) -0.017V。试计算每种溶液的pH。
2. 当下列电池中的溶液是pH = 4.00的缓冲溶液时,在25℃测得电池的电动势为 0.209V: 玻璃电极│H+(α=X )‖SCE
当缓冲溶液由未知溶液代替时,测得电池电动势如下:
(a) 0.312V; (b) 0.088V (c) -0.017V。试计算每种溶液的pH。
题目解答
答案
解:(a)pH= 4.00 + 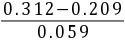 = 5.75
= 5.75
(b)pH=4.00 + 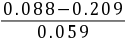 = 1.95(c) pH= 4.00 +
= 1.95(c) pH= 4.00 + 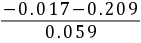 = 0.17
= 0.17
解析
步骤 1:理解电池电动势与pH的关系
电池电动势E与溶液的pH值之间存在线性关系,可以表示为E = E0 + (0.059/n) * pH,其中E0是标准电动势,n是电子转移数。对于玻璃电极与SCE组成的电池,n=1,因此E = E0 + 0.059 * pH。
步骤 2:确定标准电动势E0
已知当溶液pH = 4.00时,电池电动势E = 0.209V,代入E = E0 + 0.059 * pH,可以求得E0。
0.209 = E0 + 0.059 * 4.00
E0 = 0.209 - 0.059 * 4.00 = 0.209 - 0.236 = -0.027V
步骤 3:计算未知溶液的pH值
对于未知溶液,已知电池电动势E,代入E = E0 + 0.059 * pH,可以求得未知溶液的pH值。
(a) E = 0.312V
0.312 = -0.027 + 0.059 * pH
pH = (0.312 + 0.027) / 0.059 = 0.339 / 0.059 = 5.75
(b) E = 0.088V
0.088 = -0.027 + 0.059 * pH
pH = (0.088 + 0.027) / 0.059 = 0.115 / 0.059 = 1.95
(c) E = -0.017V
-0.017 = -0.027 + 0.059 * pH
pH = (-0.017 + 0.027) / 0.059 = 0.010 / 0.059 = 0.17
电池电动势E与溶液的pH值之间存在线性关系,可以表示为E = E0 + (0.059/n) * pH,其中E0是标准电动势,n是电子转移数。对于玻璃电极与SCE组成的电池,n=1,因此E = E0 + 0.059 * pH。
步骤 2:确定标准电动势E0
已知当溶液pH = 4.00时,电池电动势E = 0.209V,代入E = E0 + 0.059 * pH,可以求得E0。
0.209 = E0 + 0.059 * 4.00
E0 = 0.209 - 0.059 * 4.00 = 0.209 - 0.236 = -0.027V
步骤 3:计算未知溶液的pH值
对于未知溶液,已知电池电动势E,代入E = E0 + 0.059 * pH,可以求得未知溶液的pH值。
(a) E = 0.312V
0.312 = -0.027 + 0.059 * pH
pH = (0.312 + 0.027) / 0.059 = 0.339 / 0.059 = 5.75
(b) E = 0.088V
0.088 = -0.027 + 0.059 * pH
pH = (0.088 + 0.027) / 0.059 = 0.115 / 0.059 = 1.95
(c) E = -0.017V
-0.017 = -0.027 + 0.059 * pH
pH = (-0.017 + 0.027) / 0.059 = 0.010 / 0.059 = 0.17