题目
11.图为工业合成氨生产简易流程图: 原料气 净化 N2(1体积)] 有催化剂-|||-压缩机 一 热交换器 → 的答成塔 冷凝器 → 液氨-|||-H2(3体积) J N2、H2 回答下列问题: (1)合成氨所需的氮气来源于空气;合成氨所需的原料气氢气可由天然气制备,其主要反应为CH 4 (g)+H 2 O(g)=CO(g)+3H 2 (g);CH 4 和O 2 的反应:2CH 4 (g)+O 2 (g)=2CO(g)+4H 2 (g).CH 4 和H 2 O(g)及富氧空气(O 2 含量较高,不同富氧空气中氧气含量不同)混合反应,产物气体组成如表: 气体 CO H 2 N 2 O 2 体积(L) 25 60 15 2.5 计算该富氧空气中O 2 和N 2 的体积比V(O 2 ):V(N 2 )=2:3. (2)在合成氨的原科气中混有的杂质必须除去的原因是防止催化剂中毒; 上述流程中热交换器的作用是热交换器是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气.从合成塔出来的混合气体,通常仅含有15%(体积分数)的氨.为提高原料的利用率,通常采取的措施是将N 2 ,H 2 循环利用. (3)合成氮为放热反应,但工业上采用400℃-500℃的温度,主要原因是: ①该温度范围内反应速率较快.②该温度下催化剂的活性较大. (4)氨可与CO 2 反应制备尿素(CO(NH 2 ) 2 ],反应过程分为两步,试写出有关的化学方程式: ①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H 2 NCOONH 4 ):2NH 3 +CO 2 原料气 净化 N2(1体积)] 有催化剂-|||-压缩机 一 热交换器 → 的答成塔 冷凝器 → 液氨-|||-H2(3体积) J N2、H2H 2 NCOONH 4 . ②氨基甲酸铵受热分解为尿素与水:H 2 NCOONH 4 原料气 净化 N2(1体积)] 有催化剂-|||-压缩机 一 热交换器 → 的答成塔 冷凝器 → 液氨-|||-H2(3体积) J N2、H2CO(NH 2 ) 2 +H 2 O. (5)新法合成氨常采用电解法合成.即常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池中,氢气和氮气在电极上合成了氨,大大提高了氨的产率.新法合成氨所用的电解质能传导H + ,则阴极的电极反应式为N 2 +6H + +6e - ═2NH 3 .
11.图为工业合成氨生产简易流程图:
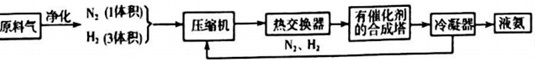
回答下列问题:
(1)合成氨所需的氮气来源于空气;合成氨所需的原料气氢气可由天然气制备,其主要反应为CH 4 (g)+H 2 O(g)=CO(g)+3H 2 (g);CH 4 和O 2 的反应:2CH 4 (g)+O 2 (g)=2CO(g)+4H 2 (g).CH 4 和H 2 O(g)及富氧空气(O 2 含量较高,不同富氧空气中氧气含量不同)混合反应,产物气体组成如表:
计算该富氧空气中O 2 和N 2 的体积比V(O 2 ):V(N 2 )=2:3.
(2)在合成氨的原科气中混有的杂质必须除去的原因是防止催化剂中毒;
上述流程中热交换器的作用是热交换器是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气.从合成塔出来的混合气体,通常仅含有15%(体积分数)的氨.为提高原料的利用率,通常采取的措施是将N 2 ,H 2 循环利用.
(3)合成氮为放热反应,但工业上采用400℃-500℃的温度,主要原因是:
①该温度范围内反应速率较快.②该温度下催化剂的活性较大.
(4)氨可与CO 2 反应制备尿素(CO(NH 2 ) 2 ],反应过程分为两步,试写出有关的化学方程式:
①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H 2 NCOONH 4 ):2NH 3 +CO 2 H 2 NCOONH 4 .
H 2 NCOONH 4 .
②氨基甲酸铵受热分解为尿素与水:H 2 NCOONH 4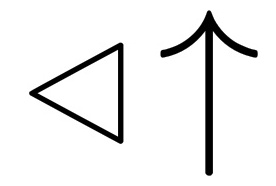 CO(NH 2 ) 2 +H 2 O.
CO(NH 2 ) 2 +H 2 O.
(5)新法合成氨常采用电解法合成.即常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池中,氢气和氮气在电极上合成了氨,大大提高了氨的产率.新法合成氨所用的电解质能传导H + ,则阴极的电极反应式为N 2 +6H + +6e - ═2NH 3 .

回答下列问题:
(1)合成氨所需的氮气来源于空气;合成氨所需的原料气氢气可由天然气制备,其主要反应为CH 4 (g)+H 2 O(g)=CO(g)+3H 2 (g);CH 4 和O 2 的反应:2CH 4 (g)+O 2 (g)=2CO(g)+4H 2 (g).CH 4 和H 2 O(g)及富氧空气(O 2 含量较高,不同富氧空气中氧气含量不同)混合反应,产物气体组成如表:
| 气体 | CO | H 2 | N 2 | O 2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
(2)在合成氨的原科气中混有的杂质必须除去的原因是防止催化剂中毒;
上述流程中热交换器的作用是热交换器是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气.从合成塔出来的混合气体,通常仅含有15%(体积分数)的氨.为提高原料的利用率,通常采取的措施是将N 2 ,H 2 循环利用.
(3)合成氮为放热反应,但工业上采用400℃-500℃的温度,主要原因是:
①该温度范围内反应速率较快.②该温度下催化剂的活性较大.
(4)氨可与CO 2 反应制备尿素(CO(NH 2 ) 2 ],反应过程分为两步,试写出有关的化学方程式:
①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H 2 NCOONH 4 ):2NH 3 +CO 2
 H 2 NCOONH 4 .
H 2 NCOONH 4 .②氨基甲酸铵受热分解为尿素与水:H 2 NCOONH 4
 CO(NH 2 ) 2 +H 2 O.
CO(NH 2 ) 2 +H 2 O.(5)新法合成氨常采用电解法合成.即常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池中,氢气和氮气在电极上合成了氨,大大提高了氨的产率.新法合成氨所用的电解质能传导H + ,则阴极的电极反应式为N 2 +6H + +6e - ═2NH 3 .
题目解答
答案
分析 (1)根据空气中含有大量的氮气分析;根据反应的方程式结合表中数据列方程式计算;
(2)根据合成氨在催化剂高温高压条件下进行,则在合成氨的原科气中混有的杂质必须除去的原因是防止催化剂中毒;热交换器的作用是充分利用能源,降低成本;物质的循环使用可以节约原料,提高利用率;
(3)采用400℃-500℃的温度,根据合成氨为放热反应,对氨的合成不利,但可考虑催化剂的活性增大反应速率;
(4)根据反应前后原子守恒书写化学方程式;
(5)电解池的阴极发生得电子的还原反应,总反应式减去阳极电极反应式,即为阴极电极反应式.
(2)根据合成氨在催化剂高温高压条件下进行,则在合成氨的原科气中混有的杂质必须除去的原因是防止催化剂中毒;热交换器的作用是充分利用能源,降低成本;物质的循环使用可以节约原料,提高利用率;
(3)采用400℃-500℃的温度,根据合成氨为放热反应,对氨的合成不利,但可考虑催化剂的活性增大反应速率;
(4)根据反应前后原子守恒书写化学方程式;
(5)电解池的阴极发生得电子的还原反应,总反应式减去阳极电极反应式,即为阴极电极反应式.
解答 解:(1)因为空气中含有大量的氮气,并且成本很低,所以合成氨所需的氮气来源于空气;
设反应消耗的H 2 O为xmol,O 2 为ymol,则根据CH 4 (g)+H 2 O(g)=CO(g)+3H 2 (g)和2CH 4 (g)+O 2 (g)=2CO(g)+4H 2 (g),
得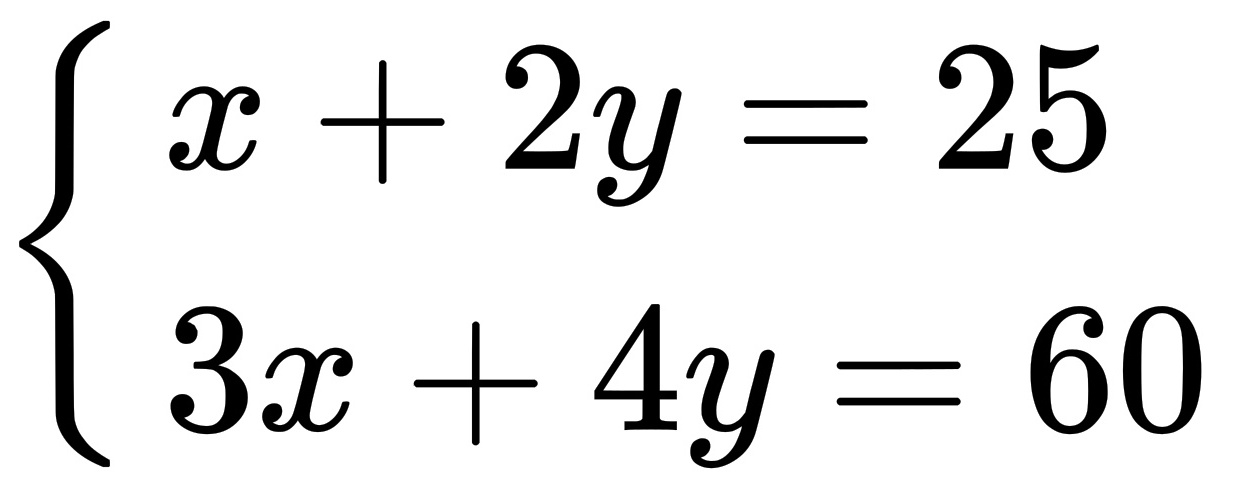
x=10,y=7.5
V(O 2 ):V(N 2 )=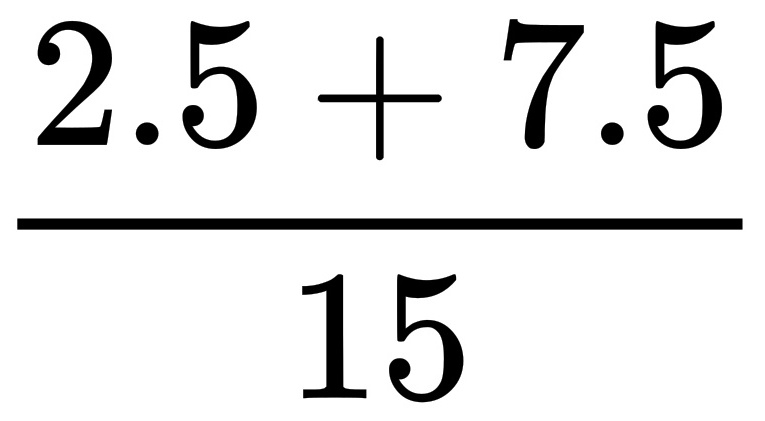 =2:3,
=2:3,
故答案为:空气;2:3;
(2)因为合成氨的原科气中混有的杂质可能使催化剂中毒,所以在合成氨的原科气中混有的杂质必须除去;热交换器的作用是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气,充分利用能源,降低成本;未反应的N 2 和H 2 ,可以循环使用,这样循环可以提高原料气的利用率,
故答案为:防止催化剂中毒;热交换器是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气;将N 2 ,H 2 循环利用;
(3)采用400℃-500℃的温度,根据合成氨为放热反应,对氨的合成不利,但该温度范围内反应速率较快,主要考虑催化剂的活性较大,
故答案为:该温度下催化剂的活性较大;
(4)①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H 2 NCOONH 4 ),则发生的化学方程式为:2NH 3 +CO 2 H 2 NCOONH 4 ,
H 2 NCOONH 4 ,
故答案为:2NH 3 +CO 2 H 2 NCOONH 4 ;
H 2 NCOONH 4 ;
②氨基甲酸铵受热分解为尿素与水,则发生的化学方程式为:H 2 NCOONH 4 CO(NH 2 ) 2 +H 2 O,故答案为:H 2 NCOONH 4
CO(NH 2 ) 2 +H 2 O,故答案为:H 2 NCOONH 4  CO(NH 2 ) 2 +H 2 O;
CO(NH 2 ) 2 +H 2 O;
(5)总反应式为N 2 +3H 2 =2NH 3 ,阳极的电极反应为3H 2 -6e - ═6H + ,总反应式减去阳极电极反应式即为阴极电极反应式,所以阴极电极反应式为:N 2 +6H + +6e - ═2NH 3 ,
故答案为:N 2 +6H + +6e - ═2NH 3 .
设反应消耗的H 2 O为xmol,O 2 为ymol,则根据CH 4 (g)+H 2 O(g)=CO(g)+3H 2 (g)和2CH 4 (g)+O 2 (g)=2CO(g)+4H 2 (g),
得
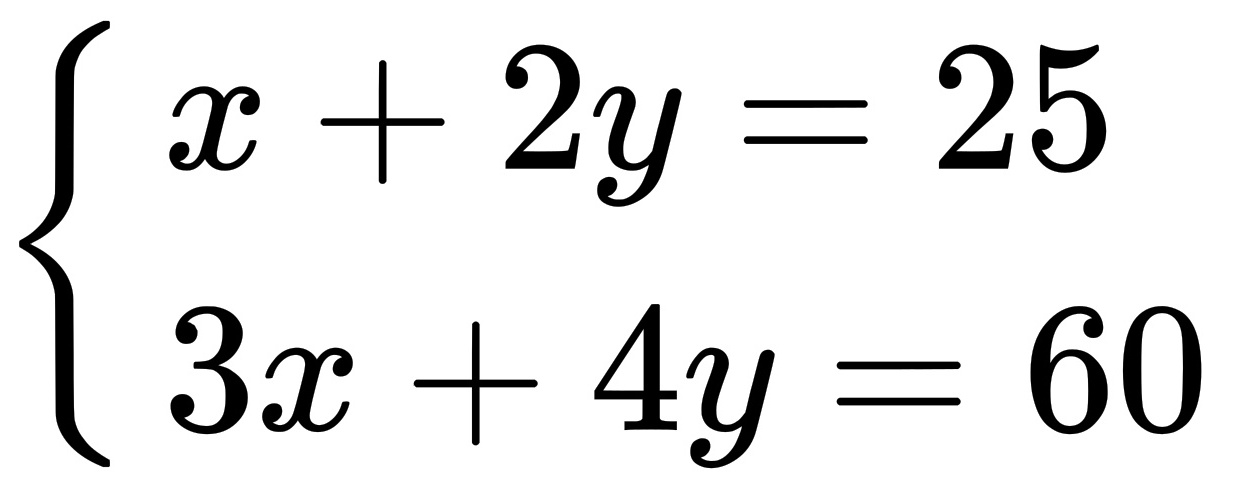
x=10,y=7.5
V(O 2 ):V(N 2 )=
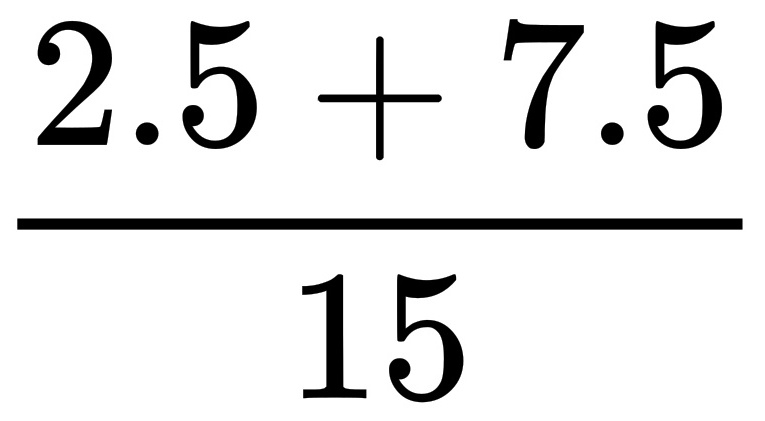 =2:3,
=2:3,故答案为:空气;2:3;
(2)因为合成氨的原科气中混有的杂质可能使催化剂中毒,所以在合成氨的原科气中混有的杂质必须除去;热交换器的作用是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气,充分利用能源,降低成本;未反应的N 2 和H 2 ,可以循环使用,这样循环可以提高原料气的利用率,
故答案为:防止催化剂中毒;热交换器是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气;将N 2 ,H 2 循环利用;
(3)采用400℃-500℃的温度,根据合成氨为放热反应,对氨的合成不利,但该温度范围内反应速率较快,主要考虑催化剂的活性较大,
故答案为:该温度下催化剂的活性较大;
(4)①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H 2 NCOONH 4 ),则发生的化学方程式为:2NH 3 +CO 2
 H 2 NCOONH 4 ,
H 2 NCOONH 4 ,故答案为:2NH 3 +CO 2
 H 2 NCOONH 4 ;
H 2 NCOONH 4 ;②氨基甲酸铵受热分解为尿素与水,则发生的化学方程式为:H 2 NCOONH 4
 CO(NH 2 ) 2 +H 2 O,故答案为:H 2 NCOONH 4
CO(NH 2 ) 2 +H 2 O,故答案为:H 2 NCOONH 4  CO(NH 2 ) 2 +H 2 O;
CO(NH 2 ) 2 +H 2 O;(5)总反应式为N 2 +3H 2 =2NH 3 ,阳极的电极反应为3H 2 -6e - ═6H + ,总反应式减去阳极电极反应式即为阴极电极反应式,所以阴极电极反应式为:N 2 +6H + +6e - ═2NH 3 ,
故答案为:N 2 +6H + +6e - ═2NH 3 .
点评 本题考查学生合成氨的原理以及应用等知识,侧重于学生分析能力和问题解决能力的考查,注重于化学对生活、生产的指导,难度中等.