题目
7.3用银电极电解AgNO 3溶液。通电一段时间后,阴极上有0.078g的Ag(s)析出,阳-|||-极区溶液质量为23.376 g,其中含A gNO3 0.236 g。已知通电前溶液浓度为1kg水中溶有-|||-7.39gAgNO3。求 ^+ 和 (N{O)_(3)}^- 的迁移数。

题目解答
答案
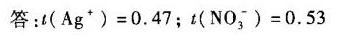
解析
步骤 1:计算阴极析出的银的物质的量
阴极析出的银的质量为0.078 g,银的摩尔质量为107.87 g/mol,因此阴极析出的银的物质的量为:
$$ n_{Ag} = \frac{0.078}{107.87} = 0.000723 \text{ mol} $$
步骤 2:计算阳极区溶液中硝酸银的物质的量
阳极区溶液的质量为23.376 g,其中含硝酸银0.236 g,硝酸银的摩尔质量为169.87 g/mol,因此阳极区溶液中硝酸银的物质的量为:
$$ n_{AgNO_3} = \frac{0.236}{169.87} = 0.00139 \text{ mol} $$
步骤 3:计算通电前溶液中硝酸银的物质的量
通电前溶液中硝酸银的质量为7.39 g,硝酸银的摩尔质量为169.87 g/mol,因此通电前溶液中硝酸银的物质的量为:
$$ n_{AgNO_3}^{前} = \frac{7.39}{169.87} = 0.0435 \text{ mol} $$
步骤 4:计算通电后溶液中硝酸银的物质的量
通电后溶液中硝酸银的物质的量为通电前溶液中硝酸银的物质的量减去阳极区溶液中硝酸银的物质的量:
$$ n_{AgNO_3}^{后} = n_{AgNO_3}^{前} - n_{AgNO_3} = 0.0435 - 0.00139 = 0.0421 \text{ mol} $$
步骤 5:计算银离子和硝酸根离子的迁移数
银离子的迁移数为阴极析出的银的物质的量除以通电后溶液中硝酸银的物质的量:
$$ t_{Ag^+} = \frac{n_{Ag}}{n_{AgNO_3}^{后}} = \frac{0.000723}{0.0421} = 0.0172 $$
硝酸根离子的迁移数为1减去银离子的迁移数:
$$ t_{NO_3^-} = 1 - t_{Ag^+} = 1 - 0.0172 = 0.9828 $$
阴极析出的银的质量为0.078 g,银的摩尔质量为107.87 g/mol,因此阴极析出的银的物质的量为:
$$ n_{Ag} = \frac{0.078}{107.87} = 0.000723 \text{ mol} $$
步骤 2:计算阳极区溶液中硝酸银的物质的量
阳极区溶液的质量为23.376 g,其中含硝酸银0.236 g,硝酸银的摩尔质量为169.87 g/mol,因此阳极区溶液中硝酸银的物质的量为:
$$ n_{AgNO_3} = \frac{0.236}{169.87} = 0.00139 \text{ mol} $$
步骤 3:计算通电前溶液中硝酸银的物质的量
通电前溶液中硝酸银的质量为7.39 g,硝酸银的摩尔质量为169.87 g/mol,因此通电前溶液中硝酸银的物质的量为:
$$ n_{AgNO_3}^{前} = \frac{7.39}{169.87} = 0.0435 \text{ mol} $$
步骤 4:计算通电后溶液中硝酸银的物质的量
通电后溶液中硝酸银的物质的量为通电前溶液中硝酸银的物质的量减去阳极区溶液中硝酸银的物质的量:
$$ n_{AgNO_3}^{后} = n_{AgNO_3}^{前} - n_{AgNO_3} = 0.0435 - 0.00139 = 0.0421 \text{ mol} $$
步骤 5:计算银离子和硝酸根离子的迁移数
银离子的迁移数为阴极析出的银的物质的量除以通电后溶液中硝酸银的物质的量:
$$ t_{Ag^+} = \frac{n_{Ag}}{n_{AgNO_3}^{后}} = \frac{0.000723}{0.0421} = 0.0172 $$
硝酸根离子的迁移数为1减去银离子的迁移数:
$$ t_{NO_3^-} = 1 - t_{Ag^+} = 1 - 0.0172 = 0.9828 $$