题目
已知固体苯的蒸气压在273 K时为3.27 kPa,293 K时为12.30 kPa;液体苯的蒸气压在293 K时为10.02 kPa,液体苯的摩尔汽化焓为ΔvapHm=34.17 kJ·mol-1。试计算:(1)在 303 K 时液体苯的蒸气压,设摩尔气化焓在此温度区间内是常数;(2)苯的摩尔升华焓;(3)苯的摩尔熔化焓。
已知固体苯的蒸气压在273 K时为3.27 kPa,293 K时为12.30 kPa;液体苯的蒸气压在293 K时为10.02 kPa,液体苯的摩尔汽化焓为ΔvapHm=34.17 kJ·mol-1。试计算:
(1)在 303 K 时液体苯的蒸气压,设摩尔气化焓在此温度区间内是常数;
(2)苯的摩尔升华焓;
(3)苯的摩尔熔化焓。
题目解答
答案
解:(1)用Clausius-Clapeyron 方程求出液态苯在303 K时的蒸气压
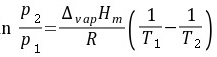
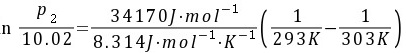
p2=15.91 kPa
(2)用Clausius-Clapeyron 方程求出固体苯的摩尔升华焓
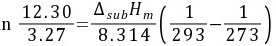
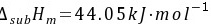
(3)苯的摩尔熔化焓等于摩尔升华焓减去摩尔汽化焓
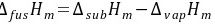
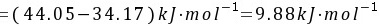
解析
步骤 1:计算液体苯在303 K时的蒸气压
使用Clausius-Clapeyron方程,该方程描述了物质的蒸气压与温度之间的关系。方程为:
$n\dfrac {{p}_{2}}{{p}_{1}}=\dfrac {\Delta vap{H}_{m}}{R}(\dfrac {1}{{T}_{1}}-\dfrac {1}{{T}_{2}})$
其中,$p_1$ 和 $p_2$ 分别是两个不同温度下的蒸气压,$T_1$ 和 $T_2$ 是对应的温度,$\Delta vapH_m$ 是摩尔汽化焓,$R$ 是理想气体常数。
步骤 2:计算苯的摩尔升华焓
同样使用Clausius-Clapeyron方程,但这次是计算固体苯的蒸气压与温度之间的关系,从而得到摩尔升华焓。
步骤 3:计算苯的摩尔熔化焓
根据热力学原理,物质的摩尔熔化焓等于摩尔升华焓减去摩尔汽化焓。
使用Clausius-Clapeyron方程,该方程描述了物质的蒸气压与温度之间的关系。方程为:
$n\dfrac {{p}_{2}}{{p}_{1}}=\dfrac {\Delta vap{H}_{m}}{R}(\dfrac {1}{{T}_{1}}-\dfrac {1}{{T}_{2}})$
其中,$p_1$ 和 $p_2$ 分别是两个不同温度下的蒸气压,$T_1$ 和 $T_2$ 是对应的温度,$\Delta vapH_m$ 是摩尔汽化焓,$R$ 是理想气体常数。
步骤 2:计算苯的摩尔升华焓
同样使用Clausius-Clapeyron方程,但这次是计算固体苯的蒸气压与温度之间的关系,从而得到摩尔升华焓。
步骤 3:计算苯的摩尔熔化焓
根据热力学原理,物质的摩尔熔化焓等于摩尔升华焓减去摩尔汽化焓。