题目
2.Na2HPO4水溶液的质子条件为

题目解答
答案
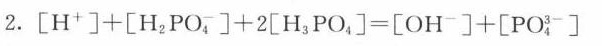
解析
质子条件是溶液中所有阳离子的正电荷总量等于阴离子的负电荷总量,即电中性原则。对于Na₂HPO₄水溶液,需考虑以下关键点:
- Na⁺为强碱阳离子,浓度固定,不影响质子平衡;
- HPO₄²⁻为弱酸根,会发生水解,生成H₂PO₄⁻、PO₄³⁻等物种;
- 水的自偶解离产生H⁺和OH⁻。
核心思路:通过电中性原则,平衡溶液中所有带电粒子的电荷,排除强电解质(Na⁺)的影响,建立弱酸根及其水解产物的电荷关系。
Na₂HPO₄解离为2Na⁺和HPO₄²⁻。根据电中性原则,阳离子总正电荷等于阴离子总负电荷:
$2[\text{Na}^+] + [\text{H}^+] = 2[\text{HPO}_4^{2-}] + [\text{H}_2\text{PO}_4^-] + 3[\text{PO}_4^{3-}] + [\text{OH}^-]$
排除强离子Na⁺的影响,移项得:
$[\text{H}^+] = 2[\text{HPO}_4^{2-}] + [\text{H}_2\text{PO}_4^-] + 3[\text{PO}_4^{3-}] + [\text{OH}^-] - 2[\text{Na}^+]$
由于Na⁺浓度固定,质子条件简化为:
$[\text{H}^+] + [\text{H}_2\text{PO}_4^-] + 2[\text{H}_5\text{PO}_4^{2-}] = [\text{OH}^-] + [\text{PO}_4^{3-}]$
(注:$\text{H}_5\text{PO}_4^{2-}$为$\text{HPO}_4^{2-}$的另一种表示形式)