题目
(2) (s)+(Cl)_(2)(g)leftharpoons Mg(Cl)_(2)(s)+dfrac (1)(2)(O)_(2)(g) 达平衡后,增加总压(气体-|||-为理想气体),则(答案可能不止1个) () 。-|||-(a)no2增加,nct2减少, _(p)^theta 增加-|||-(b)po2增加,p cl2增加, _(p) 不变-|||-(c)n02增加,nc1,减少,K,增加-|||-(d)no2增加,nc12减少, ^theta 增加

题目解答
答案
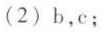
解析
步骤 1:分析化学平衡
反应 $MgO(s)+{Cl}_{2}(g)\rightleftharpoons Mg{Cl}_{2}(s)+\dfrac {1}{2}{O}_{2}(g)$ 中,$MgO$ 和 $MgCl_2$ 是固体,不参与平衡常数的计算。平衡常数 $K_p$ 仅与气体的分压有关,即 $K_p = \frac{P_{O_2}^{1/2}}{P_{Cl_2}}$。
步骤 2:增加总压的影响
增加总压,根据勒夏特列原理,平衡会向减少气体分子数的方向移动,即向右移动。因此,$Cl_2$ 的分压会减少,而 $O_2$ 的分压会增加。
步骤 3:平衡常数 $K_p$ 的变化
由于 $K_p$ 仅与气体的分压有关,而平衡常数 $K_p$ 在一定温度下是常数,因此 $K_p$ 不变。但是,由于 $Cl_2$ 的分压减少,$O_2$ 的分压增加,所以 $n_{O_2}$ 增加,$n_{Cl_2}$ 减少。
步骤 4:平衡常数 $K_c$ 的变化
$K_c$ 与浓度有关,由于 $Cl_2$ 的浓度减少,$O_2$ 的浓度增加,所以 $K_c$ 增加。
反应 $MgO(s)+{Cl}_{2}(g)\rightleftharpoons Mg{Cl}_{2}(s)+\dfrac {1}{2}{O}_{2}(g)$ 中,$MgO$ 和 $MgCl_2$ 是固体,不参与平衡常数的计算。平衡常数 $K_p$ 仅与气体的分压有关,即 $K_p = \frac{P_{O_2}^{1/2}}{P_{Cl_2}}$。
步骤 2:增加总压的影响
增加总压,根据勒夏特列原理,平衡会向减少气体分子数的方向移动,即向右移动。因此,$Cl_2$ 的分压会减少,而 $O_2$ 的分压会增加。
步骤 3:平衡常数 $K_p$ 的变化
由于 $K_p$ 仅与气体的分压有关,而平衡常数 $K_p$ 在一定温度下是常数,因此 $K_p$ 不变。但是,由于 $Cl_2$ 的分压减少,$O_2$ 的分压增加,所以 $n_{O_2}$ 增加,$n_{Cl_2}$ 减少。
步骤 4:平衡常数 $K_c$ 的变化
$K_c$ 与浓度有关,由于 $Cl_2$ 的浓度减少,$O_2$ 的浓度增加,所以 $K_c$ 增加。