高分速求——无机化工产品品质检验——4道解答题有一H2SO4和HNO3的混合液,准确称取2.2234g,酚酞为指示剂,采用NaOH直接滴定,消耗25.67ml,已知c(NaOH)=0.9935mol/L,ω(HNO3)=10.15%,计算硫酸的质量分数。M(HNO3)=63.01g/mol,M(H2SO4)=98.07g/mol取混合碱0.3525g,以酚酞作指示剂,用0.1013mol/LHCL标准溶液滴定至终点用去酸溶液23.01mL。再加甲基橙指示液,继续滴至甲基橙变色为终点,又耗去酸标液20.22ml.求试样中各组分的质量分数.M(NaOH)=40.00g/mol,M(Na2CO3)=106.0g/mol,M(NaHCO3)=84.01g/mol测定铝盐中铝的含量时,称取试样0.2117g,溶解后加入0.04997mol/LEDTA溶液30.00mL,于ph=5-6,以XO为指示剂,,用0.02146mol/L的Zn2+标准溶液22.56mL返滴定。求试样中Al2O3的质量分数。[M(Al2O3)=102.0g·mol-1]称取铁矿石式样0.25000g,经处理后,沉淀形式为Fe(OH)3,称量形式为Fe2O3,质量为0.2490,求Fe和Fe3O4的质量分数M(Fe)=55.85g/mol,M(Fe3O4)=231.5g/mol,M(Fe2O3)=159.7g/mol
有一H2SO4和HNO3的混合液,准确称取2.2234g,酚酞为指示剂,采用NaOH直接滴定,消耗25.67ml,已知c(NaOH)=0.9935mol/L,ω(HNO3)=10.15%,计算硫酸的质量分数。M(HNO3)=63.01g/mol,M(H2SO4)=98.07g/mol
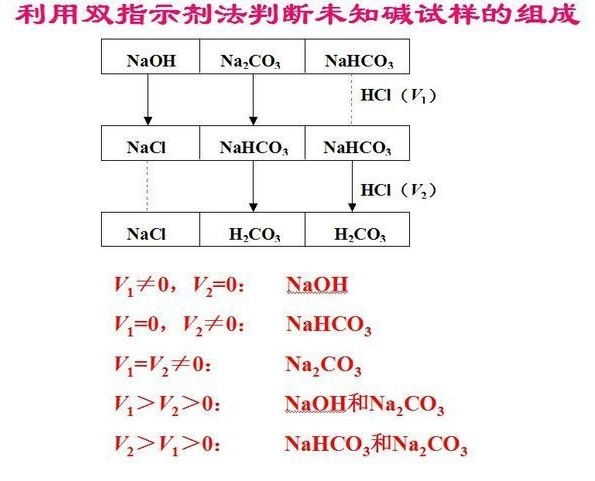
取混合碱0.3525g,以酚酞作指示剂,用0.1013mol/LHCL标准溶液滴定至终点用去酸溶液23.01mL。再加甲基橙指示液,继续滴至甲基橙变色为终点,又耗去酸标液20.22ml.求试样中各组分的质量分数.M(NaOH)=40.00g/mol,M(Na2CO3)=106.0g/mol,M(NaHCO3)=84.01g/mol
测定铝盐中铝的含量时,称取试样0.2117g,溶解后加入0.04997mol/LEDTA溶液30.00mL,于ph=5-6,以XO为指示剂,,用0.02146mol/L的Zn2+标准溶液22.56mL返滴定。求试样中Al2O3的质量分数。[M(Al2O3)=102.0g·mol-1]
称取铁矿石式样0.25000g,经处理后,沉淀形式为Fe(OH)3,称量形式为Fe2O3,质量为0.2490,求Fe和Fe3O4的质量分数M(Fe)=55.85g/mol,M(Fe3O4)=231.5g/mol,M(Fe2O3)=159.7g/mol
题目解答
答案
第一题不知道。
称取混合碱0.3525g,以酚酞作指示剂,用0.1013mol/LHCl标准溶液滴定至终点用去酸溶液23.10mL;再加甲基橙指示液,继续滴至甲基橙变色为终点,又耗去酸标液20.22mL。问此混合碱试样是由何组分组成?各组分的质量分数是多少?
[M(NaOH)=40.00g/mol;M(Na2CO3)=106.0g/mol;M(NaHCO3)=84.01g/mol]
(组分:NaOH和Na2CO3,NaOH和Na2CO3质量分数分别为3.31%和61.59%)
解:设用酚酞作指示剂时,消耗HCl溶液为V1mL,用甲基橙为指示剂时,消耗HClV2mL
∵V1>V2>0 ∴样品由NaOH和Na2CO3组成
测定铝盐含量时,称取试样0.2117g溶解后加入c(EDTA)=0.04997mol/L的EDTA标准溶液30.00ml,于pH=5~6,以XO为指示剂,用c(Zn)=0.02146mol?L的Zn标准溶液返滴定,用去22.56ml,计算试样中Al2O3的质量分数。[M(Al2O3)=101.96g.mol](24.44%)氧化还原滴定法
Fe2O3中Fe的量是:2*55.85*(0.249/(55.85*2+16*3))=A(先假设为A)
由于Fe2O3中的Fe来至矿石所以Fe%=A/0.25=29.04%
试样中的Fe完全是Fe3O4里的铁,计算出Fe的mol质量A/55.85=B,然后B/3就为Fe3O4的mol质量所以Fe3O4%=B/3*(55.85*3+16*4)/0.25=42.12%