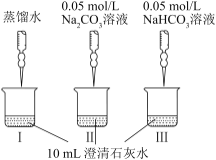
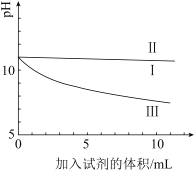
某实验小组用pH传感器探究Na2CO3、NaHCO3与澄清石灰水的反应。实验过程及结果如表:实验过程实验结果0.05mol/L 0.05mol/L-|||-蒸馏水 Na2CO3溶液 NaHCO3溶液-|||-I Ⅲ-|||-10mL澄清石灰水烧杯中溶液pH变化如图:0.05mol/L 0.05mol/L-|||-蒸馏水 Na2CO3溶液 NaHCO3溶液-|||-I Ⅲ-|||-10mL澄清石灰水下列说法不正确的是A.I是空白实验,排除因体积变化对II、III溶液pH的影响B.II的烧杯中产生白色沉淀C.II和I的pH曲线基本重合,说明II中OH-没有参加反应D.III比II的pH曲线低,说明III初期发生反应:HCO0.05mol/L 0.05mol/L-|||-蒸馏水 Na2CO3溶液 NaHCO3溶液-|||-I Ⅲ-|||-10mL澄清石灰水+OH-=CO0.05mol/L 0.05mol/L-|||-蒸馏水 Na2CO3溶液 NaHCO3溶液-|||-I Ⅲ-|||-10mL澄清石灰水+H2O
实验过程 | 实验结果 |
| 烧杯中溶液pH变化如图: |
下列说法不正确的是
A.I是空白实验,排除因体积变化对II、III溶液pH的影响
B.II的烧杯中产生白色沉淀
C.II和I的pH曲线基本重合,说明II中OH-没有参加反应
D.III比II的pH曲线低,说明III初期发生反应:HCO![]() +OH-=CO
+OH-=CO![]() +H2O
+H2O
题目解答
答案

解析
本题通过pH变化曲线探究Na2CO3、NaHCO3与澄清石灰水的反应,考查学生对酸碱反应、离子反应方程式的理解,以及实验设计与数据分析能力。解题关键在于:
- 空白实验的作用:排除无关变量(如体积变化)对实验结果的影响;
- pH曲线变化的本质:反映溶液中OH⁻浓度的变化,进而推断反应类型;
- 离子反应方程式的书写:需结合物质的量比例和反应顺序。
选项分析
A.I是空白实验,排除因体积变化对II、III溶液pH的影响
正确。空白实验(I)通过加入蒸馏水,确保II、III实验中pH变化仅由试剂反应引起,而非溶液体积变化导致的浓度改变。
B.II的烧杯中产生白色沉淀
正确。Na2CO3与澄清石灰水中的Ca²⁺反应:
$\text{CO}_3^{2-} + \text{Ca}^{2+} \rightarrow \text{CaCO}_3 \downarrow$
生成白色CaCO3沉淀。
C.II和I的pH曲线基本重合,说明II中OH⁻没有参加反应
正确。若CO3²⁻与OH⁻反应,会消耗OH⁻导致pH下降,但II的pH曲线与空白实验(I)一致,说明CO3²⁻仅与Ca²⁺反应,未与OH⁻发生反应。
D.III比II的pH曲线低,说明III初期发生反应:HCO3⁻ + OH⁻ → CO3²⁻ + H2O
错误。NaHCO3与澄清石灰水反应时,HCO3⁻优先与Ca²⁺反应:
$\text{HCO}_3^- + \text{Ca}^{2+} + \text{OH}^- \rightarrow \text{CaCO}_3 \downarrow + \text{H}_2\text{O}$
此反应消耗OH⁻,导致pH下降。而选项中未体现Ca²⁺的参与,反应式不完整且不符合实际反应顺序。