题目
下列指定化学用语正确的是( )。 A.的电离方程式: B. 的电离方程式: C. 的电离方程式: D.水解的离子方程式:
下列指定化学用语正确的是( )。
A.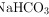 的电离方程式:
的电离方程式: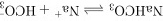
B. 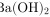 的电离方程式:
的电离方程式: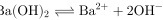
C. 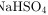 的电离方程式:
的电离方程式: 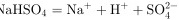
D.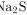 水解的离子方程式:
水解的离子方程式: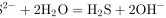
题目解答
答案
C. 的电离方程式: $NaHS{O}_{4}={Na}^{+}+{H}^{+}+{S{O}_{4}}^{2-}$
解析
步骤 1:分析NaHCO3的电离方程式
NaHCO3在水中完全电离为Na+和HCO3-,因此电离方程式应为$NaHC{O}_{3}={Na}^{+}+{HC{O}_{3}}^{-}$,而不是$NaHC{O}_{3}\rightleftharpoons {Na}^{+}+{HC{O}_{3}}^{-}$,因为它是完全电离的,不是可逆反应。
步骤 2:分析Ba(OH)2的电离方程式
Ba(OH)2在水中完全电离为Ba2+和2OH-,因此电离方程式应为$Ba{(OH)}_{2}={Ba}^{2+}+2{OH}^{-}$,而不是$3a{(OH)}_{2}\rightleftharpoons {{Ba}^{2+}}+2{OH}^{-}$,因为它是完全电离的,不是可逆反应,且系数3a是错误的。
步骤 3:分析NaHSO4的电离方程式
NaHSO4在水中完全电离为Na+、H+和SO42-,因此电离方程式为$\sqrt {a}HS{O}_{4}={Na}^{+}+{H}^{+}+{S{O}_{4}}^{2-}$,这是正确的。
步骤 4:分析Na2S水解的离子方程式
Na2S在水中水解生成H2S和OH-,但正确的水解方程式应为${S}^{2-}+2{H}_{2}O\rightleftharpoons {H}_{2}S+2{OH}^{-}$,而不是${}^{2-}+2{H}_{2}O={H}_{2}S+2{OH}^{-}$,因为水解是可逆反应。
NaHCO3在水中完全电离为Na+和HCO3-,因此电离方程式应为$NaHC{O}_{3}={Na}^{+}+{HC{O}_{3}}^{-}$,而不是$NaHC{O}_{3}\rightleftharpoons {Na}^{+}+{HC{O}_{3}}^{-}$,因为它是完全电离的,不是可逆反应。
步骤 2:分析Ba(OH)2的电离方程式
Ba(OH)2在水中完全电离为Ba2+和2OH-,因此电离方程式应为$Ba{(OH)}_{2}={Ba}^{2+}+2{OH}^{-}$,而不是$3a{(OH)}_{2}\rightleftharpoons {{Ba}^{2+}}+2{OH}^{-}$,因为它是完全电离的,不是可逆反应,且系数3a是错误的。
步骤 3:分析NaHSO4的电离方程式
NaHSO4在水中完全电离为Na+、H+和SO42-,因此电离方程式为$\sqrt {a}HS{O}_{4}={Na}^{+}+{H}^{+}+{S{O}_{4}}^{2-}$,这是正确的。
步骤 4:分析Na2S水解的离子方程式
Na2S在水中水解生成H2S和OH-,但正确的水解方程式应为${S}^{2-}+2{H}_{2}O\rightleftharpoons {H}_{2}S+2{OH}^{-}$,而不是${}^{2-}+2{H}_{2}O={H}_{2}S+2{OH}^{-}$,因为水解是可逆反应。