题目
3.已知物质A的分解反应是一级反应。在一定温度下,当A的起始浓度为 .1molcdot (dm)^-3 时,分解20%-|||-的A需时50 min 。试计算:(1)该反应的速率系数k;(2)该反应的半衰期t12;(3)当A的起始浓度为 .02molcdot (dm)^-3-|||-时,分解20%的A所需的时间。

题目解答
答案
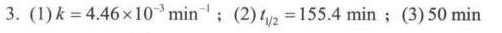
解析
步骤 1:计算速率系数k
一级反应的速率方程为 $\ln\left(\frac{[A]_0}{[A]}\right) = kt$,其中 $[A]_0$ 是起始浓度,$[A]$ 是反应时间t后的浓度,k是速率系数。已知 $[A]_0 = 0.1mol\cdot {dm}^{-3}$,分解20%的A意味着 $[A] = 0.8[A]_0 = 0.08mol\cdot {dm}^{-3}$,反应时间t = 50min。将这些值代入速率方程,可以计算出速率系数k。
步骤 2:计算半衰期t1/2
一级反应的半衰期公式为 ${t}_{1/2} = \frac{\ln 2}{k}$,其中k是速率系数。使用步骤1中计算出的速率系数k,可以计算出半衰期t1/2。
步骤 3:计算分解20%的A所需的时间
当A的起始浓度为 $0.02mol\cdot {dm}^{-3}$ 时,分解20%的A意味着 $[A] = 0.8[A]_0 = 0.016mol\cdot {dm}^{-3}$。使用步骤1中计算出的速率系数k,代入速率方程 $\ln\left(\frac{[A]_0}{[A]}\right) = kt$,可以计算出分解20%的A所需的时间t。
一级反应的速率方程为 $\ln\left(\frac{[A]_0}{[A]}\right) = kt$,其中 $[A]_0$ 是起始浓度,$[A]$ 是反应时间t后的浓度,k是速率系数。已知 $[A]_0 = 0.1mol\cdot {dm}^{-3}$,分解20%的A意味着 $[A] = 0.8[A]_0 = 0.08mol\cdot {dm}^{-3}$,反应时间t = 50min。将这些值代入速率方程,可以计算出速率系数k。
步骤 2:计算半衰期t1/2
一级反应的半衰期公式为 ${t}_{1/2} = \frac{\ln 2}{k}$,其中k是速率系数。使用步骤1中计算出的速率系数k,可以计算出半衰期t1/2。
步骤 3:计算分解20%的A所需的时间
当A的起始浓度为 $0.02mol\cdot {dm}^{-3}$ 时,分解20%的A意味着 $[A] = 0.8[A]_0 = 0.016mol\cdot {dm}^{-3}$。使用步骤1中计算出的速率系数k,代入速率方程 $\ln\left(\frac{[A]_0}{[A]}\right) = kt$,可以计算出分解20%的A所需的时间t。