计算合成氨反应 N2(g)+ 3H2(g)= 2NH3(g) 在673K时的标准平衡常数,并指出在673K,下列三种情况下反应向何方向进行?(1)p(NH3)= 304kPa,p(N2)= 171kPa,p(H2)= 2022kPa;(2)p(NH3)= 600kPa,p(N2)= 625kPa,p(H2)= 1875kPa;(3)p(NH3)= 100kPa,p(N2)= 725kPa,p(H2)= 2175kPa;
计算合成氨反应 N2(g)+ 3H2(g)= 2NH3(g) 在673K时的标准平衡常数,并指出在673K,下列三种情况下反应向何方向进行?
(1)p(NH3)= 304kPa,p(N2)= 171kPa,p(H2)= 2022kPa;
(2)p(NH3)= 600kPa,p(N2)= 625kPa,p(H2)= 1875kPa;
(3)p(NH3)= 100kPa,p(N2)= 725kPa,p(H2)= 2175kPa;
题目解答
答案
解:首先用热力学数据 求出。
查表得 N2(g) + 3H2(g) = 2 NH3(g)
△rH/( kJ•mol–1) 0 0 –46.11
S/(J·mol–1·K–1) 191.50 130.57 192.34
△rH= 2×(– 46.11)= – 92.22 kJ·mol–1
△rS= 2×192.34 – 3×130.57 – 191.50 = – 198.53 J·mol–1·K–1
△rG (673K)= △rH– T△rS= – 92.22×– (– 198.53)×10–3
= 41.39kJ·mol–1·K–1
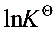 =
=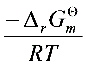 =
=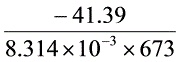 = – 7.397 ;
= – 7.397 ;
K = 6.13×10 – 4, 再求出各条件下的
= 6.13×10 – 4, 再求出各条件下的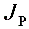 ,与
,与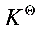 进行比较。
进行比较。
(1) J1=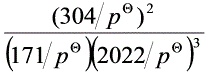 =6.5×10 – 4 J1> K
=6.5×10 – 4 J1> K ∴反应逆向进行
∴反应逆向进行
在计算压力商(J)时,各项一定要用相对压力,而且注意分子和分母的单位要一致,在此单位用的是kPa,得出的结果J 与K 进行比较后,做出判断。
进行比较后,做出判断。
(2) J2=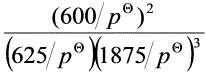 =8.7×10 – 4 J2> K
=8.7×10 – 4 J2> K ∴逆向进行
∴逆向进行
(3) J3=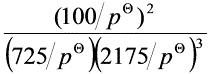 =1.0×10 –5 J3< K
=1.0×10 –5 J3< K ∴正向进行
∴正向进行
解析
本题主要考察热力学在化学反应方向判断中的应用,具体涉及利用热力学数据计算标准平衡常数,并通过比较压力商与标准平衡常数判断反应方向。
一、计算673K时的标准平衡常数
1. 基础数据与热力学量计算
合成氨反应:$\text{N}_2(g) + 3\text{H}_2(g) = 2\text{NH}_3(g)$
查表得各物质的热力学数据(673K):
- $\Delta_fH^\theta(\text{NH}_3) = -46.11\ \text{kJ/mol}$,$\Delta_fH^\theta(\text{N}_2)=\Delta_fH^\theta(\text{H}_2)=0$
- $S^\theta(\text{N}_2)=191.50\ \text{J/(mol·K)}$,$S^\theta(\text{H}_2)=130.57\ \text{J/(mol·K)}$,$S^\theta(\text{NH}_3)=192.34\ \text{J/(mol·K)}$
2. 反应的焓变$\Delta_rH^\theta$
$\Delta_rH^\theta = \sum \nu_i\Delta_fH^\theta(\text{生成物}) - \sum \nu_j\Delta_fH^\theta(\text{反应物})$
$\Delta_rH^\theta = 2\times(-46.11) - [1\times0 + 3\times0] = -92.22\ \text{kJ/mol}$
3. 反应的熵变$\Delta_rS^\theta$
$\Delta_rS^\theta = \sum \nu_iS^\theta(\text{生成物}) - \sum \nu_jS^\theta(\text{反应物})$
$\Delta_rS^\theta = 2\times192.34 - [1\times191.50 + 3\times130.57] = -198.53\ \text{J/(mol·K)}$
4. 反应的吉布斯自由能变$\Delta_rG^\theta(673K)$
$\Delta_rG^\theta = \Delta_rH^\theta - T\Delta_rS^\theta$
$\Delta_rG^\theta = -92.22\ \text{kJ/mol} - 673\ \text{K}\times(-198.53\times10^{-3}\ \text{kJ/(mol·K)}) = 41.39\ \text{kJ/mol}$
5. 标准平衡常数$K^\theta$
利用关系式$\Delta_rG^\theta = -RT\ln K^\theta$,得:
$\ln K^\theta = -\frac{\Delta_rG^\theta}{RT} = -\frac{41.39\ \text{kJ/mol}}{8.314\times10^{-3}\ \text{kJ/(mol·K)}\times673\ \text{K}} \approx -7.397$
$K^\theta \approx e^{-7.397} \approx 6.13\times10^{-4}$
二、判断不同条件下反应方向
反应商$J = \frac{(p_{\text{NH}_3}/p^\theta)^2}{(p_{\text{N}_2}/p^\theta)(p_{\text{H}_2}/p^\theta)^3}$,若$J > K^\theta$反应逆向,$J < K^\theta$反应正向($p^\theta=100\ \text{kPa}$)。
1. 条件(1)
$p(\text{NH}_3)=304\ \text{kPa}$,$p(\text{N}_2)=171\ \text{kPa}$,$p(\text{H}_2)=2022\ \text{kPa}$
$J_1 = \frac{(304/100)^2}{(171/100)(2022/100)^3} \approx 6.5\times10^{-4}$
$J_1 > K^\theta$,逆向进行。
2. 条件(2)
$p(\text{NH}_3)=600\ \text{kPa}$,$p(\text{N}_2)=625\ \text{kPa}$,$p(\text{H}_2)=1875\ \text{kPa}$
$J_2 = \frac{(600/100)^2}{(625/100)(1875/100)^3} \approx 8.7\times10^{-4}$
$J_2 > K^\theta$,逆向进行。
3. 条件(3)
$p(\text{NH}_3)=100\ \text{kPa}$,$p(\text{N}_2)=725\ \text{kPa}$,$p(\text{H}_2)=2175\ \text{kPa}$
$J_3 = \frac{(100/100)^2}{(725/100)(2175/100)^3} \approx 1.0\times10^{-5}$
$J_3 < K^\theta$,正向进行。