题目
NiSO4主要用于电镀工业,作为电镀镍和化学镍的主要原料,也是生产其他镍盐(如氧化镍、硫酸镍铵、碳酸镍等)的主要原料。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如图:(NH4)2SO4 95℃热水 NaF 萃 取 剂-|||-广渣 → 研磨 → 600℃焙烧 → 浸泡 → 浸取液 → 除钙 → 萃取-|||-浸渣 废渣-|||-NiSO4+-···---机机相-|||-(再生后循环利用)有机相已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有 ____ (写化学式)。(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为 ____ 。(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L-1),当溶液中c(F-)=2.0×10-3.5mol•L-1时,除钙率为 ____ [Ksp(CaF2)=4.0×10-11]。(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相)⇌FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 ____ 。在 ____ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。(NH4)2SO4 95℃热水 NaF 萃 取 剂-|||-广渣 → 研磨 → 600℃焙烧 → 浸泡 → 浸取液 → 除钙 → 萃取-|||-浸渣 废渣-|||-NiSO4+-···---机机相-|||-(再生后循环利用)有机相(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。(NH4)2SO4 95℃热水 NaF 萃 取 剂-|||-广渣 → 研磨 → 600℃焙烧 → 浸泡 → 浸取液 → 除钙 → 萃取-|||-浸渣 废渣-|||-NiSO4+-···---机机相-|||-(再生后循环利用)有机相①电解时阳极的电极反应式为 ____ ,离子交换膜(b)为 ____ (填“阴”或“阳”)离子交换膜。②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为 ____ 。
NiSO4主要用于电镀工业,作为电镀镍和化学镍的主要原料,也是生产其他镍盐(如氧化镍、硫酸镍铵、碳酸镍等)的主要原料。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如图:
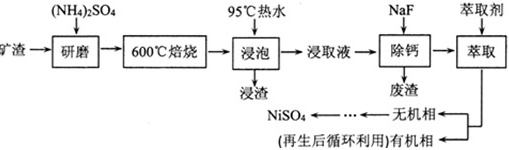
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有 ____ (写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为 ____ 。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L-1),当溶液中c(F-)=2.0×10-3.5mol•L-1时,除钙率为 ____ [Ksp(CaF2)=4.0×10-11]。
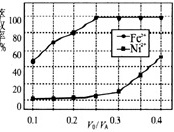
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相)⇌FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 ____ 。在 ____ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。
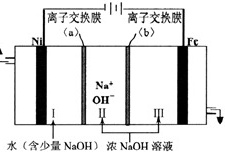
①电解时阳极的电极反应式为 ____ ,离子交换膜(b)为 ____ (填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为 ____ 。

已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有 ____ (写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为 ____ 。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L-1),当溶液中c(F-)=2.0×10-3.5mol•L-1时,除钙率为 ____ [Ksp(CaF2)=4.0×10-11]。
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相)⇌FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 ____ 。在 ____ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。

(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。

①电解时阳极的电极反应式为 ____ ,离子交换膜(b)为 ____ (填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为 ____ 。
题目解答
答案
解:(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有 SiO2,
故答案为:SiO2;
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O,
故答案为:4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O;
(3)当溶液中c(F-)=2.0×10-3mol•L-1时,c(Ca2+)=$\frac{4.0×1{0}^{-11}}{(2.0×1{0}^{-3})^{2}}$mol•L-1=1.0×10-5mol•L-1,除钙率为$\frac{1.0×1{0}^{-3}-1.0×1{0}^{-5}}{1.0×1{0}^{-3}}×100%$=99%,
故答案为:99%;
(4)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图2所示,最佳取值是亚铁离子能被萃取,镍离子不被萃取,V0/VA的最佳取值是0.25,由Fe2+(水相)+2RH(有机相)⇌FeR(有机相)+2H+(水相)可知,应在强酸性介质中“反萃取”能使有机相再生而循环利用;
故答案为:0.25;强酸性;
(5)①电解池中阳极发生氧化反应,依据题意可知铁在阳极失去电子,碱性环境下生成高铁酸根离子,电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,离子交换膜(b))为阴离子交换膜,可使氢氧根离子进入阳极区,
故答案为:Fe-6e-+8OH-=FeO42-+4H2O;阴;
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。
故答案为:SiO2;
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O,
故答案为:4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O;
(3)当溶液中c(F-)=2.0×10-3mol•L-1时,c(Ca2+)=$\frac{4.0×1{0}^{-11}}{(2.0×1{0}^{-3})^{2}}$mol•L-1=1.0×10-5mol•L-1,除钙率为$\frac{1.0×1{0}^{-3}-1.0×1{0}^{-5}}{1.0×1{0}^{-3}}×100%$=99%,
故答案为:99%;
(4)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图2所示,最佳取值是亚铁离子能被萃取,镍离子不被萃取,V0/VA的最佳取值是0.25,由Fe2+(水相)+2RH(有机相)⇌FeR(有机相)+2H+(水相)可知,应在强酸性介质中“反萃取”能使有机相再生而循环利用;
故答案为:0.25;强酸性;
(5)①电解池中阳极发生氧化反应,依据题意可知铁在阳极失去电子,碱性环境下生成高铁酸根离子,电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,离子交换膜(b))为阴离子交换膜,可使氢氧根离子进入阳极区,
故答案为:Fe-6e-+8OH-=FeO42-+4H2O;阴;
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。