(12分)某学习小组以铝铁铜合金为主要原料制备[Cu(NH3)4]SO4·H2O(一水硫酸四氨合铜)和Fe3O4胶体粒子,具体流程如下:滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v已知:①Cu(NH3)42+=Cu2++4NH3②Fe2++2Fe3++8OH−滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV vFe3O4↓+4H2O③[Cu(NH3)4]SO4易溶于水,难溶于乙醇。请回答:(1) 滤渣的成分为________。(2) 步骤Ⅰ中生成[Cu(NH3)4]SO4·H2O的离子方程式:________。步骤Ⅰ中加入(NH4)2SO4的作用是作为反应物和________。(3) 步骤Ⅳ中加入95%乙醇时,缓慢加入的目的是________。(4) 下列有关叙述正确的是________。A 步骤Ⅰ缓慢滴加H2O2并不断搅拌,有利于提高H2O2的利用率B 步骤Ⅳ若改为蒸发浓缩、冷却结晶,得到的一水硫酸四氨合铜晶体会含有较多Cu(OH)2等杂质C 步骤Ⅳ、Ⅴ用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、吸滤瓶等D 步骤Ⅴ中洗涤操作为关闭水龙头,加乙醇溶液浸没沉淀,缓慢流干,重复2~3次(5) 步骤Ⅲ中,从滤渣制备Fe3O4胶体粒子需经过一系列操作。即:滤渣中加过量NaOH溶液搅拌溶解→________→过滤、洗涤、干燥得Fe3O4胶体粒子。根据下列提供的操作,请在空格处填写正确的操作次序(填写序号)。①氮气氛围下缓慢滴加NaOH溶液,加热溶液②过滤、洗涤③加入过量稀硫酸溶解④加入适量FeSO4固体,搅拌溶解⑤测定Fe3+含量(6) 测定一水硫酸四氨合铜晶体产品的纯度,过程如下:取0.5000 g试样溶于水,滴加3 mol·L−1 H2SO4至pH为3~4,加入过量KI固体。以淀粉溶液为指示剂,生成的碘用0.1000 mol·L−1 Na2S2O3标准溶液滴定,重复2~3次,平均消耗Na2S2O3标准溶液20.00 mL。。该试样中一水硫酸四氨合铜的纯度为________。⑵乙烯和滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v发生Diels-Alder反应生成B,故B的结构简式是滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v;C为芳香族化合物,分子中只含两种不同化学环境的氢原子,“B→C”的反应中,除C外,还生成的一种无机产物是H2O;故答案为:滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v;H2O。⑶D+G→H的化学方程式是滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v;故答案为:滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v。⑷D为滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v,Q是D的同系物,相对分子质量比D大14,如果取代基为−CH2COOH、−COOH,有3种结构;如果取代基为−CH3、两个−COOH,有6种结构;如果取代基为−CH(COOH)2,有1种,则符合条件的有10种;其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v,故答案为:10;滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v。⑸CH2=CHCH=CH2和HC≡CH发生加成反应生成滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v,滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v和溴发生加成反应生成滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v,滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v发生水解反应生成滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v,其合成路线为滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v,故答案为:滤渣 →Fe3O4胶体粒子-|||-合金粉末 氨水/(NH4)2 SO4 分离 Ⅲ-|||-H2O2 II 滤液 95%乙醇, 抽滤、洗涤、干燥 →Cu(NH3)4 SO4·H2O-|||-I IV v。19、NaCN+H2O2+H2O=NH3↑+NaHCO3 三颈烧瓶 将产生的氨气及时排出并被吸收,防止产生倒吸,减少发生副反应 AB 滴入最后一滴标准硝酸银溶液,锥形瓶的溶液中恰好产生黄色沉淀,且半分钟内沉淀不消失 0.49 2HSO4—-2e-=S2O82—+2H+
(12分)某学习小组以铝铁铜合金为主要原料制备[Cu(NH3)4]SO4·H2O(一水硫酸四氨合铜)和Fe3O4胶体粒子,具体流程如下:
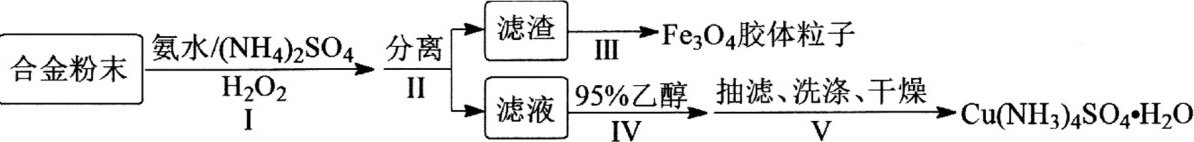
已知:①Cu(NH3)42+=Cu2++4NH3
②Fe2++2Fe3++8OH−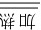 Fe3O4↓+4H2O
Fe3O4↓+4H2O
③[Cu(NH3)4]SO4易溶于水,难溶于乙醇。
请回答:
(1) 滤渣的成分为________。
(2) 步骤Ⅰ中生成[Cu(NH3)4]SO4·H2O的离子方程式:________。步骤Ⅰ中加入(NH4)2SO4的作用是作为反应物和________。
(3) 步骤Ⅳ中加入95%乙醇时,缓慢加入的目的是________。
(4) 下列有关叙述正确的是________。
A 步骤Ⅰ缓慢滴加H2O2并不断搅拌,有利于提高H2O2的利用率
B 步骤Ⅳ若改为蒸发浓缩、冷却结晶,得到的一水硫酸四氨合铜晶体会含有较多Cu(OH)2等杂质
C 步骤Ⅳ、Ⅴ用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、吸滤瓶等
D 步骤Ⅴ中洗涤操作为关闭水龙头,加乙醇溶液浸没沉淀,缓慢流干,重复2~3次
(5) 步骤Ⅲ中,从滤渣制备Fe3O4胶体粒子需经过一系列操作。即:滤渣中加过量NaOH溶液搅拌溶解→________→过滤、洗涤、干燥得Fe3O4胶体粒子。
根据下列提供的操作,请在空格处填写正确的操作次序(填写序号)。
①氮气氛围下缓慢滴加NaOH溶液,加热溶液
②过滤、洗涤
③加入过量稀硫酸溶解
④加入适量FeSO4固体,搅拌溶解
⑤测定Fe3+含量
(6) 测定一水硫酸四氨合铜晶体产品的纯度,过程如下:取0.5000 g试样溶于水,滴加3 mol·L−1 H2SO4至pH为3~4,加入过量KI固体。以淀粉溶液为指示剂,生成的碘用0.1000 mol·L−1 Na2S2O3标准溶液滴定,重复2~3次,平均消耗Na2S2O3标准溶液20.00 mL。。该试样中一水硫酸四氨合铜的纯度为________。
⑵乙烯和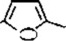 发生Diels-Alder反应生成B,故B的结构简式是
发生Diels-Alder反应生成B,故B的结构简式是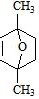 ;C为芳香族化合物,分子中只含两种不同化学环境的氢原子,“B→C”的反应中,除C外,还生成的一种无机产物是H2O;故答案为:
;C为芳香族化合物,分子中只含两种不同化学环境的氢原子,“B→C”的反应中,除C外,还生成的一种无机产物是H2O;故答案为: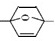 ;H2O。
;H2O。
⑶D+G→H的化学方程式是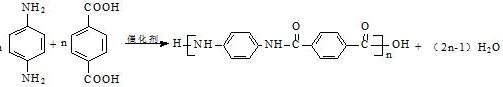 ;故答案为:
;故答案为: 。
。
⑷D为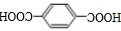 ,Q是D的同系物,相对分子质量比D大14,如果取代基为−CH2COOH、−COOH,有3种结构;如果取代基为−CH3、两个−COOH,有6种结构;如果取代基为−CH(COOH)2,有1种,则符合条件的有10种;其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为
,Q是D的同系物,相对分子质量比D大14,如果取代基为−CH2COOH、−COOH,有3种结构;如果取代基为−CH3、两个−COOH,有6种结构;如果取代基为−CH(COOH)2,有1种,则符合条件的有10种;其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为 ,故答案为:10;
,故答案为:10; 。
。
⑸CH2=CHCH=CH2和HC≡CH发生加成反应生成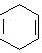 ,
, 和溴发生加成反应生成
和溴发生加成反应生成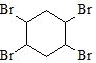 ,
, 发生水解反应生成
发生水解反应生成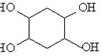 ,其合成路线为
,其合成路线为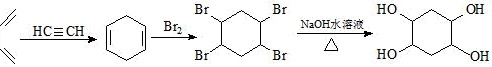 ,故答案为:
,故答案为: 。
。
19、NaCN+H2O2+H2O=NH3↑+NaHCO3 三颈烧瓶 将产生的氨气及时排出并被吸收,防止产生倒吸,减少发生副反应 AB 滴入最后一滴标准硝酸银溶液,锥形瓶的溶液中恰好产生黄色沉淀,且半分钟内沉淀不消失 0.49 2HSO4—-2e-=S2O82—+2H+
题目解答
答案
Al(OH)3、Fe(OH)3 Cu+H2O2+2NH3+2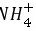 =Cu(NH3)42++2H2O或Cu+H2O2+2NH3·H2O+2
=Cu(NH3)42++2H2O或Cu+H2O2+2NH3·H2O+2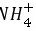 = Cu(NH3)42++4H2O 抑制NH3·H2O的电离或促进生成Cu(NH3)42+(
= Cu(NH3)42++4H2O 抑制NH3·H2O的电离或促进生成Cu(NH3)42+(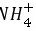 与反应生成的OH−成NH3·H2O,控制pH不能太大,以防H2O2在强碱条件下的分解) 有利于得到较大颗粒的晶体 ABC ②③⑤④① 98.40%
与反应生成的OH−成NH3·H2O,控制pH不能太大,以防H2O2在强碱条件下的分解) 有利于得到较大颗粒的晶体 ABC ②③⑤④① 98.40%