题目
氯气是一种重要的基础化工原料,广泛应用于含氯化工产品的生产。硫酰氯及1,4-二(氯甲基)苯等可通过氯化反应制备。(1)硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下:SO2(g)+Cl2(g)⇌SO2Cl2(g) ΔH=-67.59kJ•mol-1①若正反应的活化能为E正kJ•mol-1,则逆反应的活化能E逆= ____ kJ•mol-1(用含E正的代数式表示)。②恒容密闭容器中按不同进料比充入SO2(g)和Cl2(g),测定T1、T2、T3温度下体系达平衡时的Δp(Δp=p0-p,p0为体系初始压强,p0=240kPa,p为体系平衡压强),结果如甲。75-|||-75 70B-|||-70=-|||-65-|||-60 M (2,60) 65C-|||-60-|||-255/50 55-|||-45-|||-40 50-|||-35 T 45-|||-30 E T.-|||-25 40-|||-20 T3 35-|||-D-|||-1 1.5 2 2.5 3 3.5 4 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0-|||-n(SO2):n(Cl2) n(SO2):n(Cl2)-|||-甲 乙甲中温度由高到低的顺序为 ____ ,判断依据为 ____ 。M点Cl2的转化率为 ____ 。T1温度下用分压表示的平衡常数Kp= ____ kPa-1。③乙曲线中能准确表示T1温度下Δp随进料比变化的是 ____ (填序号)。(2)1,4-二(氯甲基)苯(D)是有机合成中的重要中间体,可由对二甲苯(X)的氯化反应合成。对二甲苯浅度氯化时反应过程为75-|||-75 70B-|||-70=-|||-65-|||-60 M (2,60) 65C-|||-60-|||-255/50 55-|||-45-|||-40 50-|||-35 T 45-|||-30 E T.-|||-25 40-|||-20 T3 35-|||-D-|||-1 1.5 2 2.5 3 3.5 4 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0-|||-n(SO2):n(Cl2) n(SO2):n(Cl2)-|||-甲 乙→_(①)^Cl_(2)75-|||-75 70B-|||-70=-|||-65-|||-60 M (2,60) 65C-|||-60-|||-255/50 55-|||-45-|||-40 50-|||-35 T 45-|||-30 E T.-|||-25 40-|||-20 T3 35-|||-D-|||-1 1.5 2 2.5 3 3.5 4 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0-|||-n(SO2):n(Cl2) n(SO2):n(Cl2)-|||-甲 乙以上各反应的速率方程均可表示为v=kc(A)c(B),其中c(A)、c(B)分别为各反应中对应反应物的浓度,k为速率常数(k1~k5分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。已知该温度下,k1:k2:k3:k4:k5=100:21:7:4:23。①30min时,c(X)=6.80mol•L-1,且30~60min内v(X)=0.042mol•L-1•min-1,反应进行到60min时,c(X)= ____ mol•L-1。②60min时,c(D)=0.099mol•L-1,若0~60min产物T的含量可忽略不计,则此时c(G)= ____ mol•L-1;60min后,随T的含量增加,(c(D))/(c(G)) ____ (填“增大”“减小”或“不变”)。
氯气是一种重要的基础化工原料,广泛应用于含氯化工产品的生产。硫酰氯及1,4-二(氯甲基)苯等可通过氯化反应制备。
(1)硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下:
SO2(g)+Cl2(g)⇌SO2Cl2(g) ΔH=-67.59kJ•mol-1
①若正反应的活化能为E正kJ•mol-1,则逆反应的活化能E逆= ____ kJ•mol-1(用含E正的代数式表示)。
②恒容密闭容器中按不同进料比充入SO2(g)和Cl2(g),测定T1、T2、T3温度下体系达平衡时的Δp(Δp=p0-p,p0为体系初始压强,p0=240kPa,p为体系平衡压强),结果如甲。
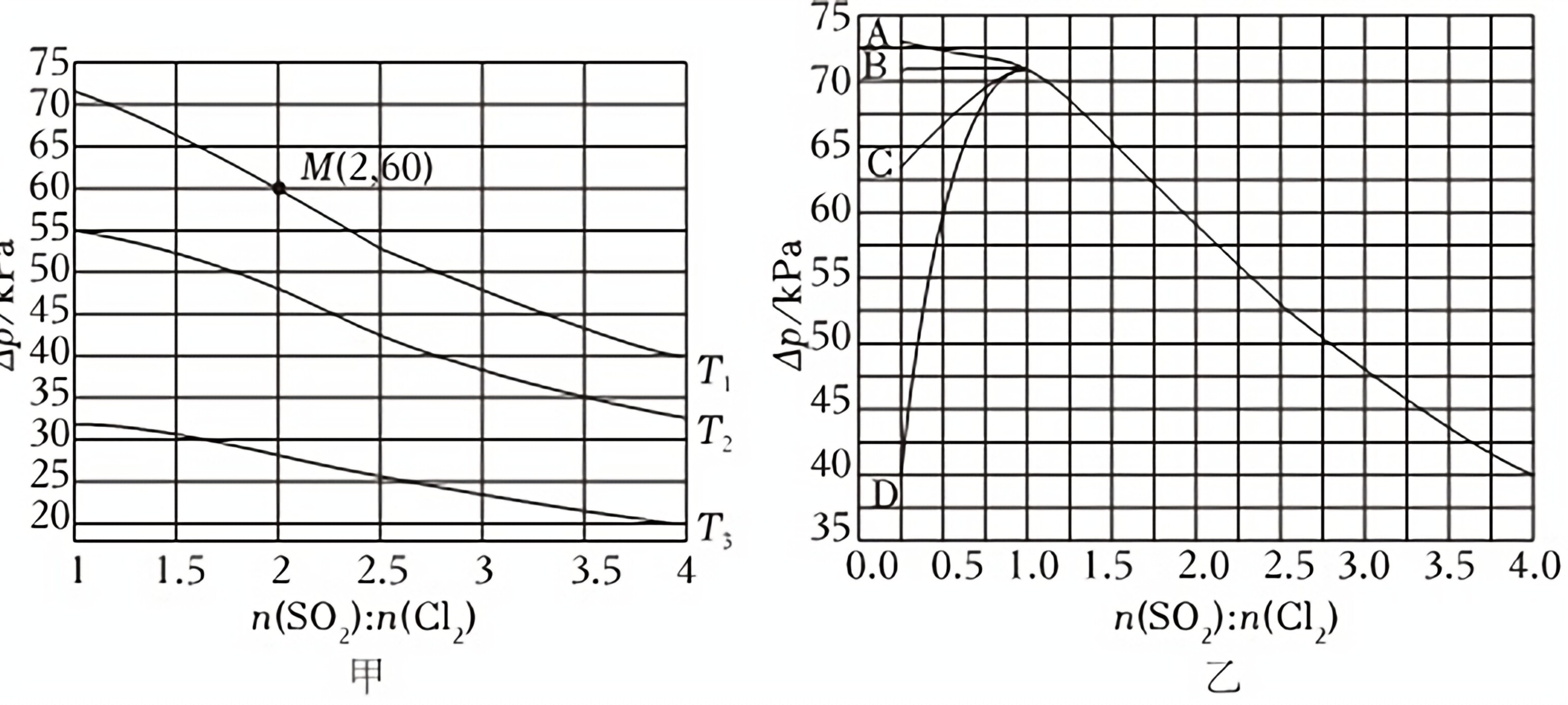
甲中温度由高到低的顺序为 ____ ,判断依据为 ____ 。M点Cl2的转化率为 ____ 。T1温度下用分压表示的平衡常数Kp= ____ kPa-1。
③乙曲线中能准确表示T1温度下Δp随进料比变化的是 ____ (填序号)。
(2)1,4-二(氯甲基)苯(D)是有机合成中的重要中间体,可由对二甲苯(X)的氯化反应合成。对二甲苯浅度氯化时反应过程为
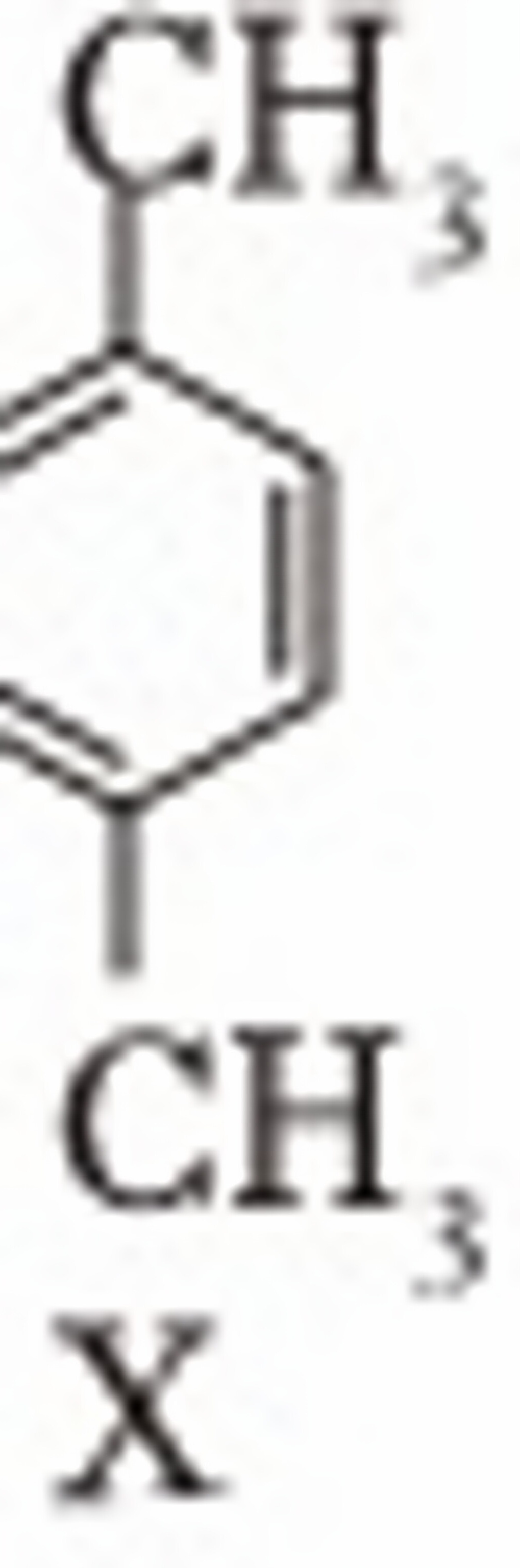 $→_{①}^{Cl_{2}}$
$→_{①}^{Cl_{2}}$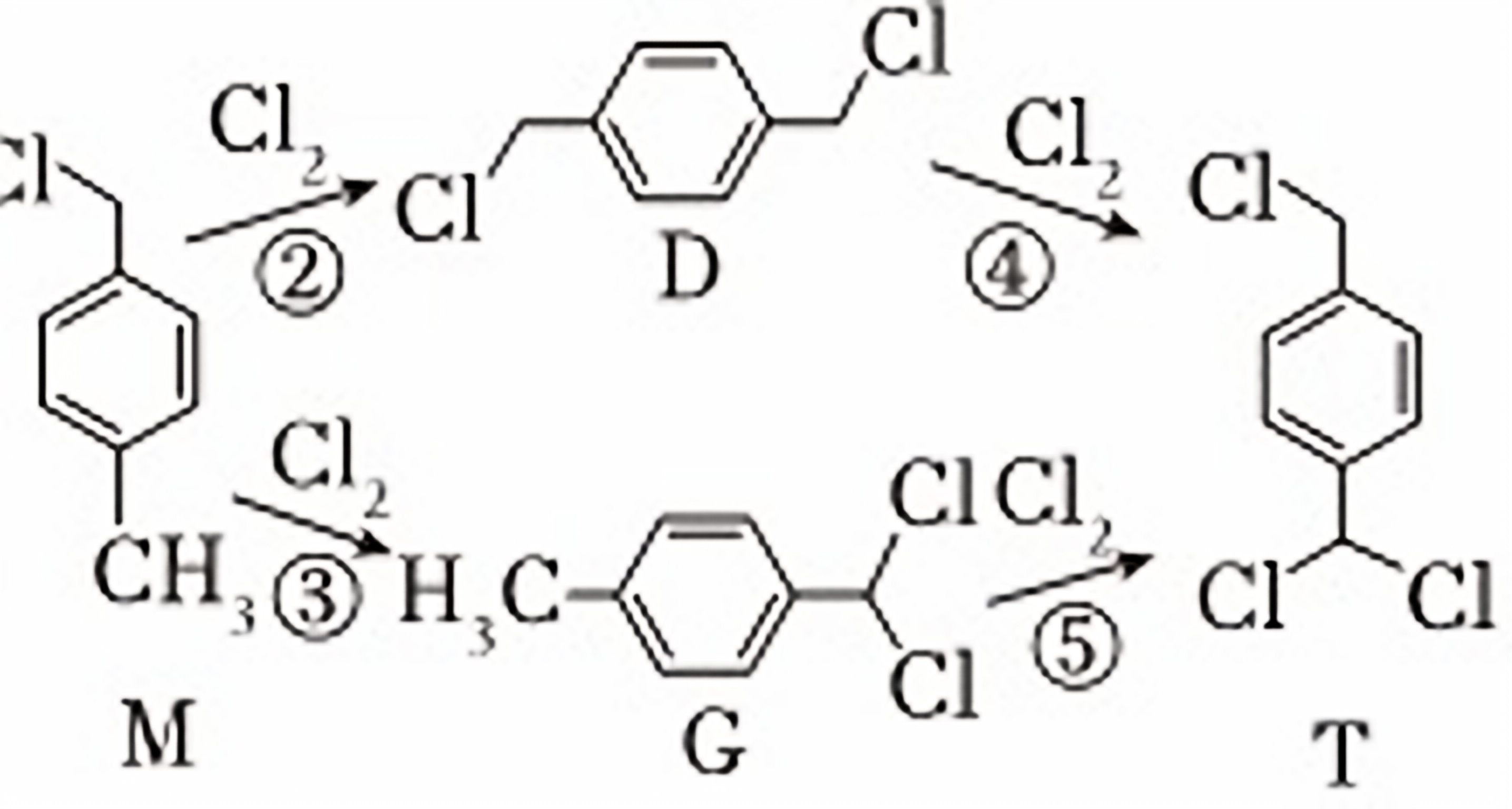
以上各反应的速率方程均可表示为v=kc(A)c(B),其中c(A)、c(B)分别为各反应中对应反应物的浓度,k为速率常数(k1~k5分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。
已知该温度下,k1:k2:k3:k4:k5=100:21:7:4:23。
①30min时,c(X)=6.80mol•L-1,且30~60min内v(X)=0.042mol•L-1•min-1,反应进行到60min时,c(X)= ____ mol•L-1。
②60min时,c(D)=0.099mol•L-1,若0~60min产物T的含量可忽略不计,则此时c(G)= ____ mol•L-1;60min后,随T的含量增加,$\frac{c(D)}{c(G)}$ ____ (填“增大”“减小”或“不变”)。
(1)硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下:
SO2(g)+Cl2(g)⇌SO2Cl2(g) ΔH=-67.59kJ•mol-1
①若正反应的活化能为E正kJ•mol-1,则逆反应的活化能E逆= ____ kJ•mol-1(用含E正的代数式表示)。
②恒容密闭容器中按不同进料比充入SO2(g)和Cl2(g),测定T1、T2、T3温度下体系达平衡时的Δp(Δp=p0-p,p0为体系初始压强,p0=240kPa,p为体系平衡压强),结果如甲。

甲中温度由高到低的顺序为 ____ ,判断依据为 ____ 。M点Cl2的转化率为 ____ 。T1温度下用分压表示的平衡常数Kp= ____ kPa-1。
③乙曲线中能准确表示T1温度下Δp随进料比变化的是 ____ (填序号)。
(2)1,4-二(氯甲基)苯(D)是有机合成中的重要中间体,可由对二甲苯(X)的氯化反应合成。对二甲苯浅度氯化时反应过程为
 $→_{①}^{Cl_{2}}$
$→_{①}^{Cl_{2}}$
以上各反应的速率方程均可表示为v=kc(A)c(B),其中c(A)、c(B)分别为各反应中对应反应物的浓度,k为速率常数(k1~k5分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。
已知该温度下,k1:k2:k3:k4:k5=100:21:7:4:23。
①30min时,c(X)=6.80mol•L-1,且30~60min内v(X)=0.042mol•L-1•min-1,反应进行到60min时,c(X)= ____ mol•L-1。
②60min时,c(D)=0.099mol•L-1,若0~60min产物T的含量可忽略不计,则此时c(G)= ____ mol•L-1;60min后,随T的含量增加,$\frac{c(D)}{c(G)}$ ____ (填“增大”“减小”或“不变”)。
题目解答
答案
:(1)①SO2(g)+Cl2(g)⇌SO2Cl2(g) ΔH=-67.59kJ•mol-1,若正反应的活化能为E正kJ•mol-1,则逆反应的活化能E逆=E正kJ•mol-1-(-67.59kJ•mol-1)=(E正+67.59)kJ•mol-1,
故答案为:(E正+67.59);
②该反应的正反应为气体体积减小的反应,因此反应正向进行程度越大,平衡时,容器中气体压强减小,△p增大,从T3到T1,△p增大,说明反应正向进行的程度逐渐增大,已知正反应为放热反应,则温度T3到T1逐渐降低,即T3>T2>T1,甲中M点可知,进料比为n(SO2):c(Cl2)=2,平衡时△p=60kPa,已知恒温恆容条件下,容器内气体物质的量之比等于气体压强之比,结合三段式列式计算,
SO2(g)+Cl2(g)⇌SO2Cl2(g)△p
起始量(kPa)160 80 0 0
变化量(kPa) 60 60 60 60
平衡量(kPa)100 20 60
M点Cl2的转化率=$\frac{60kPa}{80kPa}$×100%=75%,T1温度下用分压表示的平衡常数Kp=$\frac{p(S{O}_{2}C{l}_{2})}{p(S{O}_{2})×p(C{l}_{2})}$=$\frac{60}{100×20}$kPa-1=0.03kPa-1,
故答案为:T3>T2>T1;从T3到T1,△p增大,说明反应正向进行的程度逐渐增大,已知正反应为放热反应,则温度T3到T1逐渐降低,即T3>T2>T1;75%;0.03;
③中M点可知,进料比2时,△p=60kPa,结合三段式和T1的平衡常数可知,进料比为0.5时,△p=60kPa,则曲线D上存在(0.5,60),
故答案为:D;
(2)①30min时,c(X)=6.80mol•L-1,且30~60min内v(X)=0.042mol•L-1•min-1,反应进行到60min时,c(X)=6.80mol•L-1-v(X)×△t=6.80mol•L-1-0.042mol•L-1•min-1×30min=5.54mol/L,
故答案为:5.54;
②已知$\frac{v(D)}{v(G)}$=$\frac{△c(D)}{△c(G)}$,题给反应速率方程可知,60min时,c(D)=0.099mol•L-1,若0~60min产物T的含量可忽略不计,则此时c(G)=$\frac{v(D)}{v(G)}$=k$\frac{{k}_{2}×c(M)}{{k}_{3}×c(M)}$=$\frac{{k}_{1}}{{k}_{3}}$=3,则△c(G)=$\frac{1}{3}$△c(D)=$\frac{1}{3}$×0.099mol•L-1=0.033mol•L-1,60s后c(G)=0.033mol•L-1,60s后D和G转化为T的速率比为$\frac{{k}_{4}×c(D)}{{k}_{5}×c(G)}$=$\frac{4×0.099}{23×0.033}$,,G消耗的更快,则$\frac{c(D)}{c(G)}$ 增大,
故答案为:0.033;增大。
故答案为:(E正+67.59);
②该反应的正反应为气体体积减小的反应,因此反应正向进行程度越大,平衡时,容器中气体压强减小,△p增大,从T3到T1,△p增大,说明反应正向进行的程度逐渐增大,已知正反应为放热反应,则温度T3到T1逐渐降低,即T3>T2>T1,甲中M点可知,进料比为n(SO2):c(Cl2)=2,平衡时△p=60kPa,已知恒温恆容条件下,容器内气体物质的量之比等于气体压强之比,结合三段式列式计算,
SO2(g)+Cl2(g)⇌SO2Cl2(g)△p
起始量(kPa)160 80 0 0
变化量(kPa) 60 60 60 60
平衡量(kPa)100 20 60
M点Cl2的转化率=$\frac{60kPa}{80kPa}$×100%=75%,T1温度下用分压表示的平衡常数Kp=$\frac{p(S{O}_{2}C{l}_{2})}{p(S{O}_{2})×p(C{l}_{2})}$=$\frac{60}{100×20}$kPa-1=0.03kPa-1,
故答案为:T3>T2>T1;从T3到T1,△p增大,说明反应正向进行的程度逐渐增大,已知正反应为放热反应,则温度T3到T1逐渐降低,即T3>T2>T1;75%;0.03;
③中M点可知,进料比2时,△p=60kPa,结合三段式和T1的平衡常数可知,进料比为0.5时,△p=60kPa,则曲线D上存在(0.5,60),
故答案为:D;
(2)①30min时,c(X)=6.80mol•L-1,且30~60min内v(X)=0.042mol•L-1•min-1,反应进行到60min时,c(X)=6.80mol•L-1-v(X)×△t=6.80mol•L-1-0.042mol•L-1•min-1×30min=5.54mol/L,
故答案为:5.54;
②已知$\frac{v(D)}{v(G)}$=$\frac{△c(D)}{△c(G)}$,题给反应速率方程可知,60min时,c(D)=0.099mol•L-1,若0~60min产物T的含量可忽略不计,则此时c(G)=$\frac{v(D)}{v(G)}$=k$\frac{{k}_{2}×c(M)}{{k}_{3}×c(M)}$=$\frac{{k}_{1}}{{k}_{3}}$=3,则△c(G)=$\frac{1}{3}$△c(D)=$\frac{1}{3}$×0.099mol•L-1=0.033mol•L-1,60s后c(G)=0.033mol•L-1,60s后D和G转化为T的速率比为$\frac{{k}_{4}×c(D)}{{k}_{5}×c(G)}$=$\frac{4×0.099}{23×0.033}$,,G消耗的更快,则$\frac{c(D)}{c(G)}$ 增大,
故答案为:0.033;增大。