题目
([ Co{(N{H)_(3))}_(6)] }^2+ 属于 __ 自旋配离子,其d轨道在正八面体场中分裂为 __ 和-|||-__ 轨道,在高能量的 __ 轨道上,排布 __ 个电子,在低能量的 __ 轨-|||-道上排布 __ 个电子,中心离子采用 __ 杂化,配合物具有 __ 磁性。

题目解答
答案
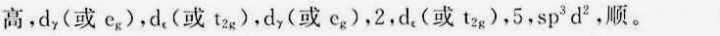
解析
步骤 1:确定自旋类型
${[ Co{(N{H}_{3})}_{6}] }^{2+}$ 中心离子为Co,其价电子构型为$3d^7 4s^2$。在形成${[ Co{(N{H}_{3})}_{6}] }^{2+}$时,Co失去两个电子,形成$3d^7$的价电子构型。由于$3d^7$中有5个电子在低能量轨道,2个电子在高能量轨道,且这些电子未全部成对,因此该配离子属于高自旋配离子。
步骤 2:确定轨道分裂
在正八面体场中,d轨道分裂为$e_g$(高能量轨道)和$t_{2g}$(低能量轨道)。$e_g$轨道包括$dz^2$和$dx^2-y^2$,$t_{2g}$轨道包括$dxy$、$dyz$和$dxz$。
步骤 3:确定电子排布
在$e_g$轨道上排布2个电子,在$t_{2g}$轨道上排布5个电子。
步骤 4:确定杂化类型
中心离子Co采用$sp^3d^2$杂化,形成正八面体构型。
步骤 5:确定磁性
由于$e_g$轨道上有2个未成对电子,因此该配合物具有顺磁性。
${[ Co{(N{H}_{3})}_{6}] }^{2+}$ 中心离子为Co,其价电子构型为$3d^7 4s^2$。在形成${[ Co{(N{H}_{3})}_{6}] }^{2+}$时,Co失去两个电子,形成$3d^7$的价电子构型。由于$3d^7$中有5个电子在低能量轨道,2个电子在高能量轨道,且这些电子未全部成对,因此该配离子属于高自旋配离子。
步骤 2:确定轨道分裂
在正八面体场中,d轨道分裂为$e_g$(高能量轨道)和$t_{2g}$(低能量轨道)。$e_g$轨道包括$dz^2$和$dx^2-y^2$,$t_{2g}$轨道包括$dxy$、$dyz$和$dxz$。
步骤 3:确定电子排布
在$e_g$轨道上排布2个电子,在$t_{2g}$轨道上排布5个电子。
步骤 4:确定杂化类型
中心离子Co采用$sp^3d^2$杂化,形成正八面体构型。
步骤 5:确定磁性
由于$e_g$轨道上有2个未成对电子,因此该配合物具有顺磁性。