题目
(22)当化学反应过程中有σ→π键型转变时-|||-(A)通常是放热反应,升高温度有利于 Delta Glt 0-|||-(B)通常是吸热反应,降低温度有利于 Delta Glt 0-|||-(C)通常是吸热反应,升高温度有利于 Delta Glt 0

题目解答
答案
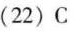
解析
步骤 1:理解σ→π键型转变
σ→π键型转变通常涉及分子中电子从σ轨道跃迁到π轨道。这种转变通常伴随着能量的吸收,因此是吸热反应。
步骤 2:分析温度对吸热反应的影响
吸热反应的焓变(ΔH)为正值,即ΔH > 0。根据吉布斯自由能变化公式ΔG = ΔH - TΔS,当ΔH > 0时,升高温度(T)会使得-TΔS的绝对值减小,从而有利于ΔG < 0,即反应自发进行。
步骤 3:确定正确选项
根据上述分析,σ→π键型转变通常是吸热反应,升高温度有利于ΔG < 0,因此正确选项是C。
σ→π键型转变通常涉及分子中电子从σ轨道跃迁到π轨道。这种转变通常伴随着能量的吸收,因此是吸热反应。
步骤 2:分析温度对吸热反应的影响
吸热反应的焓变(ΔH)为正值,即ΔH > 0。根据吉布斯自由能变化公式ΔG = ΔH - TΔS,当ΔH > 0时,升高温度(T)会使得-TΔS的绝对值减小,从而有利于ΔG < 0,即反应自发进行。
步骤 3:确定正确选项
根据上述分析,σ→π键型转变通常是吸热反应,升高温度有利于ΔG < 0,因此正确选项是C。