题目
一、判断题(每题1分,共12分)-|||-1.反应 +(O)_(2)arrow 2N(O)_(2) 的速率方程式是 =k(c)^2(NO)cdot c((O)_(2)), 该反应一定是-|||-基元反应。 ()-|||-2.热和功既不是系统的性质,也不是系统的状态函数。 ()-|||-3.将受主杂质掺入本征半导体中,称为p型半导体。 ()-|||-4.煤属于再生能源,煤油属于二次能源。 ()-|||-5.氧化反应的 (Delta )_(1)(G)_(m)-T 线位置越高,表明金属单质与氧结合能力越强。 ()-|||-6.标准条件下,反应式C(金刚石) +(O)_(2)(g)=!=!= C(O)_(2)(g) 的反应热能表示C O2的-|||-Delta (H)_(m)(298.15k) ()-|||-7.四种基本晶体中都有独立存在的小分子。 ()-|||-8.CuCl2水溶液的电解产物是:阳极- -(C)_(2), 阴极-Cu。 ()-|||-9.HF、HCl、HBr和HI中酸性最强的是HI。 ()-|||-10.室温下导电性最好的元素是Ag。 ()-|||-11.B、C、Si的单质为原子晶体,熔、沸点很高,它们形成氯化物后的熔、沸点仍很高。-|||-()-|||-12.加入催化剂能使反应速率加快,其平衡常数也随之增大。 ()

题目解答
答案
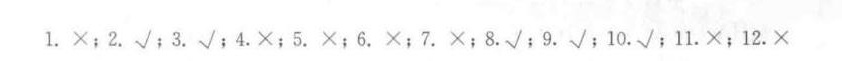
解析
本题主要考查化学反应速率、热和功、半导体、能源、氧化反应、晶体、电解、酸性、导电性等方面的知识。解题思路是根据所学的相关概念和原理,对每个判断题进行逐一分析判断。
- 对于反应 $2NO + {O}_{2} \rightarrow 2N{O}_{2}$ 的速率方程式是 $v = k{c}^{2}(NO) \cdot c({O}_{2})$ ,该反应不一定是基元反应。基元反应是一步完成的反应,而仅仅根据速率方程式不能确定反应就是基元反应,有可能是复杂反应经过一定的机理得到的速率方程式,所以该说法错误。
- 热和功既不是系统的性质,也不是系统的状态函数。系统的性质如温度、压力等,状态函数如内能、焓等,热和功是与过程有关的量,不是系统的性质和状态函数,所以该说法正确。
- 将受主杂质掺入本征半导体中,称为p型半导体。受主杂质接受电子,使半导体中形成空穴,这种半导体就是p型半导体,所以该说法正确。
- 煤属于不可再生能源,煤油属于二次能源。煤是经过漫长的地质过程形成的,短期内无法再生,所以煤是不可再生能源;煤油是由石油等经过加工得到的,属于二次能源,所以该说法错误。
- 氧化反应的 $\Delta {G}_{m}-T$ 线位置越高,表明金属单质与氧结合能力越弱。$\Delta {G}_{m}-T$ 线位置越高,说明反应的吉布斯自由能越负,反应越容易进行,但对于氧化反应来说,金属单质与氧结合能力越弱,所以该说法错误。
- 标准条件下,反应式C(金刚石) $+ {O}_{2}(g) = C{O}_{2}(g)$ 的反应热能表示CO2的 ${\Delta }_{f}{H}_{m}^{\theta }(298.15K)$ 。这里应该是表示CO2的标准生成焓,而不是反应热能,所以该说法错误。
- 四种基本晶体中,分子晶体有独立存在的小分子,而原子晶体、离子晶体、金属晶体没有独立存在的小分子,所以该说法错误。
- CuCl2水溶液的电解产物是:阳极 - ${Cl}_{2}$ ,阴极 - $Cu$ 。在电解CuCl2水溶液时,阳极氯离子失去电子生成氯气,阴极铜离子得到电子生成铜单质,所以该说法正确。
- HF、HCl、HBr和HI中酸性最强的是HI。在卤化氢中,随着卤素原子半径的增大,氢卤键的键能减小,氢卤键更容易断裂,酸性增强,所以HI的酸性最强,该说法正确。
- 室温下导电性最好的元素是Ag。在常见的金属中,银的导电性最好,所以该说法正确。
- B、C、Si的单质为原子晶体,熔、沸点很高,它们形成氯化物后的熔、沸点仍很高。B、C、Si的单质为原子晶体,熔、沸点很高,但它们形成氯化物后是分子晶体,分子间作用力较弱,熔、沸点较低,所以该说法错误。
- 加入催化剂能使反应速率加快,其平衡常数不变。催化剂能降低反应的活化能,使反应速率加快,但催化剂不能改变反应的热力学性质,平衡常数只与温度有关,与催化剂无关,所以该说法错误。