题目
一、硫酸根离子的检验实验探究:H2SO4溶液 Na2SO4溶液 Na2CO3溶液-|||-实验操作 先加入几滴8aCl2溶液,再加入少量盐酸。-|||-实验现象-|||-原理(方程式表示)思考1:向某溶液中加H2SO4溶液 Na2SO4溶液 Na2CO3溶液-|||-实验操作 先加入几滴8aCl2溶液,再加入少量盐酸。-|||-实验现象-|||-原理(方程式表示)产生白色沉淀,能否证明该溶液中一定有H2SO4溶液 Na2SO4溶液 Na2CO3溶液-|||-实验操作 先加入几滴8aCl2溶液,再加入少量盐酸。-|||-实验现象-|||-原理(方程式表示)?为什么?思考2:怎么样才能进一步确认被鉴定溶液中H2SO4溶液 Na2SO4溶液 Na2CO3溶液-|||-实验操作 先加入几滴8aCl2溶液,再加入少量盐酸。-|||-实验现象-|||-原理(方程式表示)呢?思考3:已知AgCl也不溶于算,某未知溶液H2SO4溶液 Na2SO4溶液 Na2CO3溶液-|||-实验操作 先加入几滴8aCl2溶液,再加入少量盐酸。-|||-实验现象-|||-原理(方程式表示)不溶解,证明该溶液中一定含有H2SO4溶液 Na2SO4溶液 Na2CO3溶液-|||-实验操作 先加入几滴8aCl2溶液,再加入少量盐酸。-|||-实验现象-|||-原理(方程式表示)离子。此结论是否正确?思考4:若仍然是上述试剂,应该怎么操作才能确认待测液中是否含H2SO4溶液 Na2SO4溶液 Na2CO3溶液-|||-实验操作 先加入几滴8aCl2溶液,再加入少量盐酸。-|||-实验现象-|||-原理(方程式表示)
一、硫酸根离子的检验
实验探究:
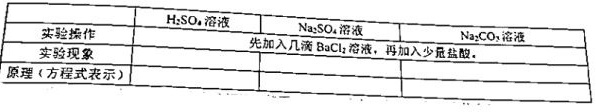
思考1:向某溶液中加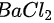 产生白色沉淀,能否证明该溶液中一定有
产生白色沉淀,能否证明该溶液中一定有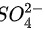 ?为什么?
?为什么?
思考2:怎么样才能进一步确认被鉴定溶液中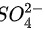 呢?
呢?
思考3:已知AgCl也不溶于算,某未知溶液 不溶解,证明该溶液中一定含有
不溶解,证明该溶液中一定含有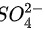 离子。此结论是否正确?
离子。此结论是否正确?
思考4:若仍然是上述试剂,应该怎么操作才能确认待测液中是否含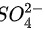
题目解答
答案
根据硫酸、硫酸钠中含有硫酸根离子,其会与钡离子结合形成白色沉淀硫酸钡,但硫酸钡不与盐酸反应;而碳酸钠与氯化钡反应生成碳酸钡,然后碳酸钡与稀盐酸反应生成二氧化;故实验现象分别为:产生白色沉淀,产生白色沉淀;又白色沉淀生成,之后沉淀消失,有气泡产生;原理: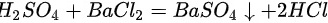 ;
;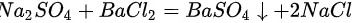 ;
;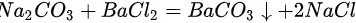 ,
,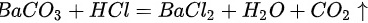 ;思考1:不能,根据氯离子和银离子也会产生白色沉淀氯化银,故应该排除氯离子的影响,才能证明一定含有硫酸根离子;
;思考1:不能,根据氯离子和银离子也会产生白色沉淀氯化银,故应该排除氯离子的影响,才能证明一定含有硫酸根离子;
思考2:根据硫酸钡沉淀不溶于算可知可以再加入稀硝酸,沉淀不溶解,就可以确定含有硫酸根离子;
思考3:不正确,有氯离子的影响。
思考4:先加入少量盐酸,若无白色沉淀,则不含氯离子;再加入氯化钡溶液,若有白色沉淀,则证明含有硫酸根离子。
解析
本题考查硫酸根离子的检验方法及干扰因素的排除。核心思路是通过钡盐沉淀法,但需注意以下关键点:
- 排除其他阴离子的干扰(如碳酸根、氯离子);
- 酸化操作的时机(通常先加酸排除碳酸根,再加钡盐);
- 氯离子对检验结果的影响(若未排除氯离子,可能误判为硫酸根存在)。
思考1
不能证明。若溶液中含有Ag+,则会与Cl−反应生成AgCl白色沉淀,无法确定是否为硫酸根离子引起的沉淀。因此需排除Ag+或CO3^2−的干扰。
思考2
进一步加入稀盐酸酸化,若沉淀不溶解,则说明是硫酸钡,可确认硫酸根离子存在。因为硫酸钡不溶于稀盐酸,而碳酸钡会溶解并产生气泡。
思考3
结论错误。若原溶液中含有Cl−,则加入BaCl2会引入Cl−,与Ag+反应生成AgCl沉淀,无法确定是否为硫酸根引起。需先排除Cl−的干扰。
思考4
正确操作步骤:
- 先加稀盐酸酸化,若无沉淀,则说明不含Ag+或CO3^2−;
- 再加BaCl2溶液,若出现白色沉淀,则证明含有硫酸根离子。