题目
A →市售的溴-|||-to C-|||-个-|||-业 尾气吸收-|||-B 浓CaBr2溶液-|||-水浴加热 热的K2C2O4溶液 D市售的溴(纯度99%)中含有少量的Cl2和I2,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓CaBr2溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为 ____ ;CaBr2溶液的作用为 ____ ;D中发生的主要反应的化学方程式为 ____ 。(2)将D中溶液转移至 ____ (填仪器名称)中,边加热边向其中滴加酸化的KMnO4溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成I2的离子方程式为 ____ 。(3)利用图示相同装置,将R和K2Cr2O7固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓H2SO4,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为 ____ 和 ____ 。(4)为保证溴的纯度,步骤(3)中K2Cr2O7固体的用量按理论所需量的(3)/(4)计算,若固体R质量为m克(以KBr计),则需称取 ____ gK2Cr2O7(M=294g•mol-1)(用含m的代数式表示)。(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用 ____ ,滤液沿烧杯壁流下。
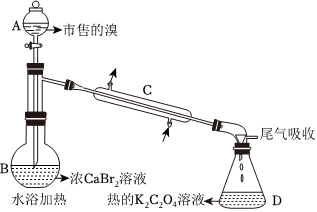 市售的溴(纯度99%)中含有少量的Cl2和I2,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。
市售的溴(纯度99%)中含有少量的Cl2和I2,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:
(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓CaBr2溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为 ____ ;CaBr2溶液的作用为 ____ ;D中发生的主要反应的化学方程式为 ____ 。
(2)将D中溶液转移至 ____ (填仪器名称)中,边加热边向其中滴加酸化的KMnO4溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成I2的离子方程式为 ____ 。
(3)利用图示相同装置,将R和K2Cr2O7固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓H2SO4,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为 ____ 和 ____ 。
(4)为保证溴的纯度,步骤(3)中K2Cr2O7固体的用量按理论所需量的$\frac{3}{4}$计算,若固体R质量为m克(以KBr计),则需称取 ____ gK2Cr2O7(M=294g•mol-1)(用含m的代数式表示)。
(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用 ____ ,滤液沿烧杯壁流下。
题目解答
答案
(1)仪器C的名称为:直形冷凝管,CaBr2溶液的作用为:除去市售的溴(纯度99%)中含有少量的Cl2,水浴加热时,溴单质、碘单质蒸发进入装置D中发生氧化还原反应,D中发生的主要反应的化学方程式为:Br2+K2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$2KBr+2CO2↑,I2+K2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$2KI+2CO2↑,
故答案为:直形冷凝管;除去市售的溴(纯度99%)中含有少量的Cl2;Br2+K2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$2KBr+2CO2↑、I2+K2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$2KI+2CO2↑;
(2)将D中溶液转移至蒸发皿中,边加热边向其中滴加酸化的KMnO4溶液至出现红棕色气体,继续加热将溶液蒸干得固体R,该过程中生成I2的离子方程式为:2${MnO}_{4}^{-}$+10I-+16H+$\frac{\underline{\;\;△\;\;}}{\;}$2Mn2++5I2+8H2O,
故答案为:蒸发皿;2${MnO}_{4}^{-}$+10I-+16H+$\frac{\underline{\;\;△\;\;}}{\;}$2Mn2++5I2+8H2O;
(3)利用图示相同装置,将R和K2Cr2O7固体混合均匀放入B中,D中加入冷的蒸馏水,由A向B中滴加适量浓H2SO4,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴,D中蒸馏水的作用为:液封和降低温度,
故答案为:液封;降低温度;
(4)保证溴的纯度,步骤(3)中K2Cr2O7固体的用量按理论所需量的$\frac{3}{4}$计算,若固体R质量为m克(以KBr计),电子守恒得到反应的定量关系,6KBr~6e-~K2Cr2O7,理论上需要K2Cr2O7的物质的量=$\frac{1}{6}$×$\frac{m}{119}$mol,实际上所需称量K2Cr2O7的质量=$\frac{1}{6}$×$\frac{m}{119}$mol×$\frac{3}{4}$×294g/mol≈0.31mg,
故答案为:0.31m;
(5)趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用:玻璃棒引流,玻璃棒下端靠在三层滤纸处,滤液沿烧杯壁流下,
故答案为:玻璃棒引流,玻璃棒下端靠在三层滤纸处。
故答案为:直形冷凝管;除去市售的溴(纯度99%)中含有少量的Cl2;Br2+K2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$2KBr+2CO2↑、I2+K2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$2KI+2CO2↑;
(2)将D中溶液转移至蒸发皿中,边加热边向其中滴加酸化的KMnO4溶液至出现红棕色气体,继续加热将溶液蒸干得固体R,该过程中生成I2的离子方程式为:2${MnO}_{4}^{-}$+10I-+16H+$\frac{\underline{\;\;△\;\;}}{\;}$2Mn2++5I2+8H2O,
故答案为:蒸发皿;2${MnO}_{4}^{-}$+10I-+16H+$\frac{\underline{\;\;△\;\;}}{\;}$2Mn2++5I2+8H2O;
(3)利用图示相同装置,将R和K2Cr2O7固体混合均匀放入B中,D中加入冷的蒸馏水,由A向B中滴加适量浓H2SO4,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴,D中蒸馏水的作用为:液封和降低温度,
故答案为:液封;降低温度;
(4)保证溴的纯度,步骤(3)中K2Cr2O7固体的用量按理论所需量的$\frac{3}{4}$计算,若固体R质量为m克(以KBr计),电子守恒得到反应的定量关系,6KBr~6e-~K2Cr2O7,理论上需要K2Cr2O7的物质的量=$\frac{1}{6}$×$\frac{m}{119}$mol,实际上所需称量K2Cr2O7的质量=$\frac{1}{6}$×$\frac{m}{119}$mol×$\frac{3}{4}$×294g/mol≈0.31mg,
故答案为:0.31m;
(5)趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用:玻璃棒引流,玻璃棒下端靠在三层滤纸处,滤液沿烧杯壁流下,
故答案为:玻璃棒引流,玻璃棒下端靠在三层滤纸处。