题目
I、为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题: -v-|||-由-|||-a (1)该反应为________反应(填“放热”或“吸热”)。 (2)A和B的总能量比C和D的总能量_________(填“高”或“低”)。 (3)该反应的物质中的化学能通过化学反应转化成________释放出来。 (4)该反应的反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。 (5)Ⅱ、同素异形体相互转化的反应热相当小,而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”观点来计算反应热。 已知: ①P 4(白磷,s)+5O 2(g)= P 4O 10(s) ΔH=-2983.2 kJ·mol − 1 ②P(红磷,s)+5/4O 2(g)=1/4P 4O 10(s) ΔH=-738.5 kJ·mol − 1 则白磷转化为红磷的热化学方程式为__________。相同状况下,能量状态较低的是________;白磷的稳定性比红磷_________(填“高”或“低”)。
I、为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
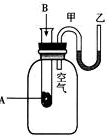
(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量_________(填“高”或“低”)。
(3)该反应的物质中的化学能通过化学反应转化成________释放出来。
(4)该反应的反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)Ⅱ、同素异形体相互转化的反应热相当小,而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”观点来计算反应热。
已知:
①P 4(白磷,s)+5O 2(g)= P 4O 10(s) ΔH=-2983.2 kJ·mol − 1
②P(红磷,s)+5/4O 2(g)=1/4P 4O 10(s) ΔH=-738.5 kJ·mol − 1
则白磷转化为红磷的热化学方程式为__________。相同状况下,能量状态较低的是________;白磷的稳定性比红磷_________(填“高”或“低”)。

(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量_________(填“高”或“低”)。
(3)该反应的物质中的化学能通过化学反应转化成________释放出来。
(4)该反应的反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)Ⅱ、同素异形体相互转化的反应热相当小,而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”观点来计算反应热。
已知:
①P 4(白磷,s)+5O 2(g)= P 4O 10(s) ΔH=-2983.2 kJ·mol − 1
②P(红磷,s)+5/4O 2(g)=1/4P 4O 10(s) ΔH=-738.5 kJ·mol − 1
则白磷转化为红磷的热化学方程式为__________。相同状况下,能量状态较低的是________;白磷的稳定性比红磷_________(填“高”或“低”)。
题目解答
答案
放热 高 热能 低 P4(白磷,s)=4P(红磷,s) △H=-29.2kJ/mol 红磷 低
解析
步骤 1:分析化学反应能量变化
当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升,这表明反应放热,因为放热反应会使U形管中的液体温度升高,从而导致液面上升。
步骤 2:确定反应物和生成物的能量关系
由于反应放热,反应物A和B的总能量高于生成物C和D的总能量。
步骤 3:确定能量转化形式
化学反应中的化学能通过化学反应转化成热能释放出来。
步骤 4:分析化学键断裂和形成能量关系
由于反应放热,反应物化学键断裂吸收的能量低于生成物化学键形成放出的能量。
步骤 5:计算白磷转化为红磷的反应热
根据盖斯定律,将两个反应式相减,得到白磷转化为红磷的反应热。
步骤 6:确定能量状态和稳定性
能量状态较低的物质更稳定,因此红磷比白磷更稳定。
当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升,这表明反应放热,因为放热反应会使U形管中的液体温度升高,从而导致液面上升。
步骤 2:确定反应物和生成物的能量关系
由于反应放热,反应物A和B的总能量高于生成物C和D的总能量。
步骤 3:确定能量转化形式
化学反应中的化学能通过化学反应转化成热能释放出来。
步骤 4:分析化学键断裂和形成能量关系
由于反应放热,反应物化学键断裂吸收的能量低于生成物化学键形成放出的能量。
步骤 5:计算白磷转化为红磷的反应热
根据盖斯定律,将两个反应式相减,得到白磷转化为红磷的反应热。
步骤 6:确定能量状态和稳定性
能量状态较低的物质更稳定,因此红磷比白磷更稳定。