题目
H3PO4的pKa1~pKa3分别为2.12,7.20,12.4。当H3PO4溶pH=7.3时溶液中的主要存在形式是( )A. _(2)P(O)_(4)^-] gt [ (HP{O)_(4)}^2-] B. _(2)P(O)_(4)^-] gt [ (HP{O)_(4)}^2-] C. _(2)P(O)_(4)^-] gt [ (HP{O)_(4)}^2-] D. _(2)P(O)_(4)^-] gt [ (HP{O)_(4)}^2-]
H3PO4的pKa1~pKa3分别为2.12,7.20,12.4。当H3PO4溶pH=7.3时溶液中的主要存在形式是( )
A.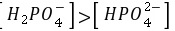
B.
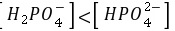
C.
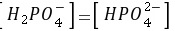
D.
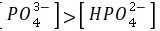
题目解答
答案
B
解析
本题考查多元弱酸在不同pH条件下的主要存在形式。关键点在于理解解离常数(pKa)与溶液pH的关系,以及如何判断各解离阶段的酸碱浓度关系。
- 核心思路:当溶液pH接近某一级解离的pKa时,该级的酸(HA)和共轭碱(A⁻)浓度接近相等;若pH > pKa,则共轭碱浓度大于酸浓度;若pH < pKa,则酸浓度大于共轭碱浓度。
- 破题关键:磷酸(H₃PO₄)的三个pKa值对应三个解离步骤,需判断pH=7.3时处于哪个解离阶段附近,并应用Henderson-Hasselbalch方程比较浓度关系。
解离步骤与pKa分析
- 第一解离:H₃PO₄ ↔ H₂PO₄⁻ + H⁺,pKa₁ = 2.12
- pH=7.3远大于pKa₁,H₃PO₄几乎完全解离为H₂PO₄⁻。
- 第二解离:H₂PO₄⁻ ↔ HPO₄²⁻ + H⁺,pKa₂ = 7.20
- pH=7.3略大于pKa₂,此时HPO₄²⁻浓度大于H₂PO₄⁻浓度。
- 第三解离:HPO₄²⁻ ↔ PO₄³⁻ + H⁺,pKa₃ = 12.4
- pH=7.3远小于pKa₃,PO₄³⁻浓度极低,可忽略。
浓度关系计算
根据Henderson-Hasselbalch方程:
$\text{pH} = \text{pKa}_2 + \log \frac{[\text{HPO₄²⁻}]}{[\text{H₂PO₄⁻}]}$
代入数值:
$7.3 = 7.20 + \log \frac{[\text{HPO₄²⁻}]}{[\text{H₂PO₄⁻}]}$
解得:
$\frac{[\text{HPO₄²⁻}]}{[\text{H₂PO₄⁻}]} = 10^{0.1} \approx 1.26$
因此,[HPO₄²⁻] > [H₂PO₄⁻],对应选项B。