题目
8-3 20℃的水与N2气逆流接触以脱除水中溶解的O2气。塔底入口的N2气中含氧0.1 %(体积分数),-|||-设气液两相在塔底达到平衡,平衡关系服从亨利定律。求下列两种情况下水离开塔底时的最低含氧-|||-量。以 /(m)^3 水表示。(1)操作压强为101.3kPa(绝压);(2)操作压强为40kPa (绝压)。

题目解答
答案
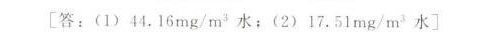
解析
步骤 1:确定亨利定律的表达式
亨利定律描述了气体在液体中的溶解度与气体分压之间的关系。对于氧气在水中的溶解,亨利定律可以表示为:
\[ p_{O_2} = H_{O_2} \cdot C_{O_2} \]
其中,$p_{O_2}$ 是氧气的分压,$H_{O_2}$ 是亨利系数,$C_{O_2}$ 是氧气在水中的浓度。
步骤 2:计算氧气的分压
在塔底,N2气中含氧0.1%(体积分数),即氧气的分压为总压的0.1%。因此,氧气的分压可以表示为:
\[ p_{O_2} = 0.001 \cdot P_{total} \]
其中,$P_{total}$ 是总压。
步骤 3:计算氧气在水中的浓度
将氧气的分压代入亨利定律的表达式,可以得到氧气在水中的浓度:
\[ C_{O_2} = \frac{p_{O_2}}{H_{O_2}} = \frac{0.001 \cdot P_{total}}{H_{O_2}} \]
其中,$H_{O_2}$ 是亨利系数,对于20℃的水,$H_{O_2} = 769.23 \, kPa \cdot m^3/mol$。
步骤 4:计算氧气在水中的浓度(单位为 $mg/m^3$)
将氧气在水中的浓度从 $mol/m^3$ 转换为 $mg/m^3$,需要乘以氧气的摩尔质量(32 g/mol):
\[ C_{O_2} = \frac{0.001 \cdot P_{total}}{H_{O_2}} \cdot 32 \cdot 1000 \, mg/m^3 \]
步骤 5:计算两种情况下的氧气浓度
(1) 操作压强为101.3kPa时:
\[ C_{O_2} = \frac{0.001 \cdot 101.3}{769.23} \cdot 32 \cdot 1000 = 44.16 \, mg/m^3 \]
(2) 操作压强为40kPa时:
\[ C_{O_2} = \frac{0.001 \cdot 40}{769.23} \cdot 32 \cdot 1000 = 17.51 \, mg/m^3 \]
亨利定律描述了气体在液体中的溶解度与气体分压之间的关系。对于氧气在水中的溶解,亨利定律可以表示为:
\[ p_{O_2} = H_{O_2} \cdot C_{O_2} \]
其中,$p_{O_2}$ 是氧气的分压,$H_{O_2}$ 是亨利系数,$C_{O_2}$ 是氧气在水中的浓度。
步骤 2:计算氧气的分压
在塔底,N2气中含氧0.1%(体积分数),即氧气的分压为总压的0.1%。因此,氧气的分压可以表示为:
\[ p_{O_2} = 0.001 \cdot P_{total} \]
其中,$P_{total}$ 是总压。
步骤 3:计算氧气在水中的浓度
将氧气的分压代入亨利定律的表达式,可以得到氧气在水中的浓度:
\[ C_{O_2} = \frac{p_{O_2}}{H_{O_2}} = \frac{0.001 \cdot P_{total}}{H_{O_2}} \]
其中,$H_{O_2}$ 是亨利系数,对于20℃的水,$H_{O_2} = 769.23 \, kPa \cdot m^3/mol$。
步骤 4:计算氧气在水中的浓度(单位为 $mg/m^3$)
将氧气在水中的浓度从 $mol/m^3$ 转换为 $mg/m^3$,需要乘以氧气的摩尔质量(32 g/mol):
\[ C_{O_2} = \frac{0.001 \cdot P_{total}}{H_{O_2}} \cdot 32 \cdot 1000 \, mg/m^3 \]
步骤 5:计算两种情况下的氧气浓度
(1) 操作压强为101.3kPa时:
\[ C_{O_2} = \frac{0.001 \cdot 101.3}{769.23} \cdot 32 \cdot 1000 = 44.16 \, mg/m^3 \]
(2) 操作压强为40kPa时:
\[ C_{O_2} = \frac{0.001 \cdot 40}{769.23} \cdot 32 \cdot 1000 = 17.51 \, mg/m^3 \]