题目
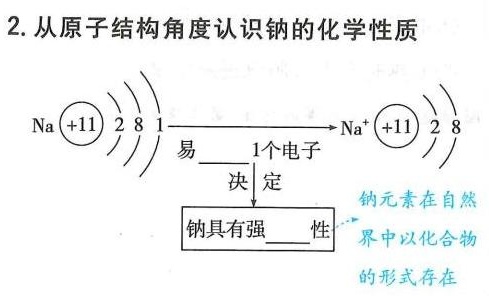
2.从原子结构角度认识钠的化学性质-|||-Na +11 2 8 1 Na^+ +11 28-|||-易 __ 1个电子-|||-决 定 钠元素在自然-|||-钠具有强 __ 性 界中以化合物-|||-的形式存在2.从原子结构角度认识钠的化学性质-|||-Na +11 2 8 1 Na^+ +11 28-|||-易 __ 1个电子-|||-决 定 钠元素在自然-|||-钠具有强 __ 性 界中以化合物-|||-的形式存在2.从原子结构角度认识钠的化学性质-|||-Na +11 2 8 1 Na^+ +11 28-|||-易 __ 1个电子-|||-决 定 钠元素在自然-|||-钠具有强 __ 性 界中以化合物-|||-的形式存在


题目解答
答案
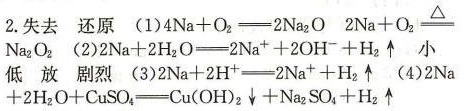
解析
步骤 1:钠的原子结构
钠原子的电子排布为 (+11)28 1,表示钠原子有11个电子,其中最外层有1个电子。钠原子容易失去这个最外层电子,形成Na^+离子,因此钠具有强还原性。
步骤 2:钠与非金属单质的反应
钠与氧气在常温下反应生成氧化钠(Na2O),在加热条件下生成过氧化钠(Na2O2)。钠与氯气反应生成氯化钠(NaCl)。
步骤 3:钠与水的反应
钠与水反应生成氢氧化钠(NaOH)和氢气(H2),反应的离子方程式为:$2Na + 2H_2O \rightarrow 2Na^+ + 2OH^- + H_2\uparrow$。反应现象包括钠浮在水面上,熔化成小球,四处游动,发出嘶嘶声,溶液变红。
步骤 4:钠与非氧化性酸的反应
钠与非氧化性酸反应生成相应的钠盐和氢气,反应的离子方程式为:$2Na + 2H^+ \rightarrow 2Na^+ + H_2\uparrow$。若酸的量不足,钠还会继续与水反应,消耗的钠与产生的氢气存在定量关系:$2Na \sim H_2$。
步骤 5:钠与盐的反应
钠与熔融盐发生置换反应,如与TiCl4反应生成Ti和NaCl。钠与盐溶液反应时先与水反应,生成的碱与盐可能发生复分解反应,如与CuSO4溶液反应生成Cu(OH)2沉淀和Na2SO4。
钠原子的电子排布为 (+11)28 1,表示钠原子有11个电子,其中最外层有1个电子。钠原子容易失去这个最外层电子,形成Na^+离子,因此钠具有强还原性。
步骤 2:钠与非金属单质的反应
钠与氧气在常温下反应生成氧化钠(Na2O),在加热条件下生成过氧化钠(Na2O2)。钠与氯气反应生成氯化钠(NaCl)。
步骤 3:钠与水的反应
钠与水反应生成氢氧化钠(NaOH)和氢气(H2),反应的离子方程式为:$2Na + 2H_2O \rightarrow 2Na^+ + 2OH^- + H_2\uparrow$。反应现象包括钠浮在水面上,熔化成小球,四处游动,发出嘶嘶声,溶液变红。
步骤 4:钠与非氧化性酸的反应
钠与非氧化性酸反应生成相应的钠盐和氢气,反应的离子方程式为:$2Na + 2H^+ \rightarrow 2Na^+ + H_2\uparrow$。若酸的量不足,钠还会继续与水反应,消耗的钠与产生的氢气存在定量关系:$2Na \sim H_2$。
步骤 5:钠与盐的反应
钠与熔融盐发生置换反应,如与TiCl4反应生成Ti和NaCl。钠与盐溶液反应时先与水反应,生成的碱与盐可能发生复分解反应,如与CuSO4溶液反应生成Cu(OH)2沉淀和Na2SO4。