题目
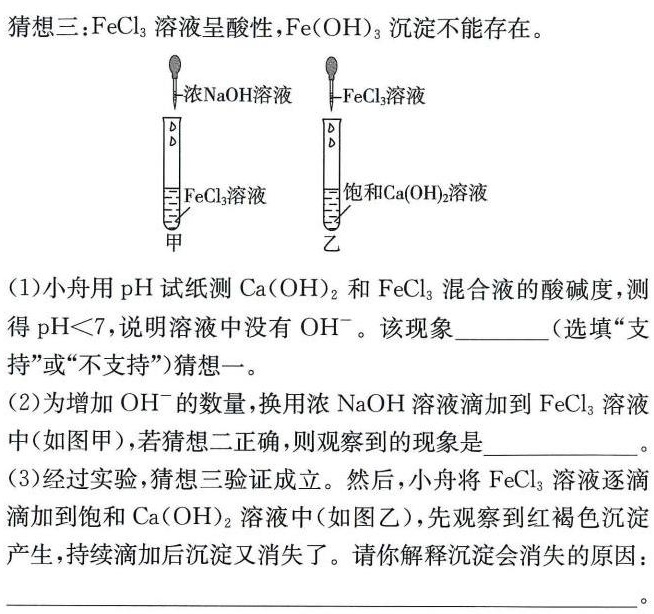
(2023·舟山中考)小舟在学习"常见的碱"过程中,将新配制的-|||-饱和Ca(OH)2溶液滴入FeCl3溶液中,发现没有出现预期的红-|||-褐色沉淀。这是为什么呢?小舟查阅资料,获取如下信息:-|||-①Ca(OH)2微溶于水;②FeCl3溶液呈酸性。于是他提出以下-|||-猜想:-|||-猜想一:Ca(OH)2没有参加化学反应。-|||-猜想二:滴入的Ca(OH)2溶液中 ^- 数量太少。(2023·舟山中考)小舟在学习"常见的碱"过程中,将新配制的-|||-饱和Ca(OH)2溶液滴入FeCl3溶液中,发现没有出现预期的红-|||-褐色沉淀。这是为什么呢?小舟查阅资料,获取如下信息:-|||-①Ca(OH)2微溶于水;②FeCl3溶液呈酸性。于是他提出以下-|||-猜想:-|||-猜想一:Ca(OH)2没有参加化学反应。-|||-猜想二:滴入的Ca(OH)2溶液中 ^- 数量太少。

题目解答
答案

解析
步骤 1:验证猜想一
小舟用pH试纸测得Ca(OH)2和FeCl3混合液的pH值小于7,说明溶液呈酸性,没有${OH}^{-}$,这不支持Ca(OH)2没有参加化学反应的猜想一。
步骤 2:验证猜想二
为增加${OH}^{-}$的数量,小舟换用浓NaOH溶液滴加到FeCl3溶液中,若猜想二正确,即${OH}^{-}$数量太少导致没有沉淀生成,那么加入浓NaOH后,由于${OH}^{-}$数量增加,应该观察到红褐色沉淀生成。
步骤 3:验证猜想三
经过实验,猜想三验证成立,即FeCl3溶液呈酸性,Fe(OH)3沉淀不能存在。当FeCl3溶液逐滴滴加到饱和Ca(OH)2溶液中时,开始时${OH}^{-}$数量较多,产生红褐色沉淀Fe(OH)3,但随着FeCl3溶液的持续滴加,${OH}^{-}$数量逐渐减少,FeCl3溶液显酸性,当FeCl3溶液过量时,产生的Fe(OH)3沉淀在酸性溶液中又消失了。
小舟用pH试纸测得Ca(OH)2和FeCl3混合液的pH值小于7,说明溶液呈酸性,没有${OH}^{-}$,这不支持Ca(OH)2没有参加化学反应的猜想一。
步骤 2:验证猜想二
为增加${OH}^{-}$的数量,小舟换用浓NaOH溶液滴加到FeCl3溶液中,若猜想二正确,即${OH}^{-}$数量太少导致没有沉淀生成,那么加入浓NaOH后,由于${OH}^{-}$数量增加,应该观察到红褐色沉淀生成。
步骤 3:验证猜想三
经过实验,猜想三验证成立,即FeCl3溶液呈酸性,Fe(OH)3沉淀不能存在。当FeCl3溶液逐滴滴加到饱和Ca(OH)2溶液中时,开始时${OH}^{-}$数量较多,产生红褐色沉淀Fe(OH)3,但随着FeCl3溶液的持续滴加,${OH}^{-}$数量逐渐减少,FeCl3溶液显酸性,当FeCl3溶液过量时,产生的Fe(OH)3沉淀在酸性溶液中又消失了。