题目
在 630 K 时,反应:2HgO(s) = 2Hg(g) + O2(g)的ΔrG = 44.3 kJmol-1。(1) 求上述反应的标准平衡常数K ;(2) 求 630 K 时 HgO(s) 的分解压力;(3) 若将 HgO(s)投入到 630 K,1.013×105Pa 的纯O2气的定体积容器中,在 630 K 时使其达平衡,求与 HgO(s) 呈平衡的气相中 Hg(g) 的分压力。
在 630 K 时,反应:2HgO(s) = 2Hg(g) + O2(g)的ΔrG 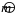 = 44.3 kJmol-1。
= 44.3 kJmol-1。
(1) 求上述反应的标准平衡常数K 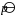 ;
;
(2) 求 630 K 时 HgO(s) 的分解压力;
(3) 若将 HgO(s)投入到 630 K,1.013×105Pa 的纯O2气的定体积容器中,在 630 K 时使其达平衡,求与 HgO(s) 呈平衡的气相中 Hg(g) 的分压力。
题目解答
答案
[答] (1) K 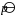 = exp(-ΔrG
= exp(-ΔrG 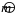 /RT) = 2.12×10-4 (3分)
/RT) = 2.12×10-4 (3分)
(2) 2HgO(s) = 2Hg(g) + O2(g)
设平衡分压为: 2p p
K 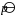 = 4p3·(p)-3 (1分)
= 4p3·(p)-3 (1分)
p = 3800 Pa (1分)
故p总= 3p = 1.1 kPa (1分)
(3) K 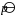 = 2.12×10-4 = (2p)2(p + 101 325 Pa) (2分)
= 2.12×10-4 = (2p)2(p + 101 325 Pa) (2分)
p = 739.7 Pa (1分)
故 p(Hg) = 2p = 1.5 kPa (1分)
解析
步骤 1:计算标准平衡常数K
根据公式 K = exp(-ΔrG / RT),其中 ΔrG = 44.3 kJ/mol,R = 8.314 J/(mol·K),T = 630 K,计算标准平衡常数K。
步骤 2:计算HgO(s)的分解压力
根据反应方程式2HgO(s) = 2Hg(g) + O2(g),设平衡分压为2p和p,根据平衡常数K = 4p^3 / p^3,计算HgO(s)的分解压力p。
步骤 3:计算Hg(g)的分压力
将HgO(s)投入到630 K, 1.013×10^5 Pa的纯O2气的定体积容器中,根据平衡常数K = 2.12×10^-4 = (2p)^2 / (p + 101325 Pa),计算Hg(g)的分压力p。
根据公式 K = exp(-ΔrG / RT),其中 ΔrG = 44.3 kJ/mol,R = 8.314 J/(mol·K),T = 630 K,计算标准平衡常数K。
步骤 2:计算HgO(s)的分解压力
根据反应方程式2HgO(s) = 2Hg(g) + O2(g),设平衡分压为2p和p,根据平衡常数K = 4p^3 / p^3,计算HgO(s)的分解压力p。
步骤 3:计算Hg(g)的分压力
将HgO(s)投入到630 K, 1.013×10^5 Pa的纯O2气的定体积容器中,根据平衡常数K = 2.12×10^-4 = (2p)^2 / (p + 101325 Pa),计算Hg(g)的分压力p。