某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量AI2O3和F.Ch,为探索 工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、 绿矶晶体(FeS047H:0)和胆矶晶体(CuS045H2O)o固体C → AlCl3溶液 → 氯化铜-|||-→ 溶液A-|||-过量CO2-|||-步骤Ⅱ-|||-溶液D固体F |f |CuSQi溶液一陋研;请回答:(1)步骤I中,发生的氧化还原反应的离子方程式为涉及到的分离操作是—o(2)试剂X是—:溶液D是—。(3)溶液E在空气中易被氧化,请设计一个简单的实验方案检验溶液E是否被氧化—.(4)在步骤H时,若用大理石与浓盐酸制取CO?并直接通入溶液A中,一段时间后,观察 到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是一。(5)工业上常用溶液E制取净水剂NazFeCU,流程如图:______|Fe(0H)3|NaC10/Na0H |^,Na2FeO4ii调pH’______混合溶液’写出由Fe(OH)3制取Na2FeO4的离子方程式_。(已知NaClO还原为NaCl)「答案J(I). 2A1+2OH +2H2O=2A1O2+3H2T(2).过滤(3).稀硫酸(或稀H2so』;或硫酸)(4).NaHCO3溶液(或碳酸氢钠溶液)(5).取少量E溶液于试管中,滴入几滴硫河化钾溶液,若溶液变为血红色,则说明E溶液已被氧化,反之,则未被氧化(6).在 通入C02之前增加一个盛有饱和NaHCOs溶液的洗气瓶,除去HC1气体(7). 2Fe(0H)3+3C10+40H =2FeO42+3Cr+5H2O「解析」1分析」Cu、Fe和Al,少量AlzOs和FezOj,氢氧化钠与Al、AhO3反应,而Cu、Fe和Fe2O3不反应,过滤得到滤渣为Cu、Fe和Fe2O3,滤液为偏铝酸钠溶液和氢氧化钠溶液,向滤液 中通入过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠溶液,过滤,向沉淀中加入盐酸生成 氯化铝溶液,最终得到氯化铝固体:向灌渣为Cu、Fe和FezCh中加入稀硫酸,生成硫酸亚 铁,最终得到绿矶,过滤得到Cu, Cu与氧气、硫酸反应得到硫酸铜。『详解J⑴步骤I中,发生的氧化还原反应的是铝和氢氧化钠反应生成偏铝酸钠和氢气,K离子方程式为2A1+2OET+2H20=2A10d+3H2T,Fe、Cu、FezCh不和氢氧化钠溶液反应,因 此涉及到的分离操作是过滤;故答案为:2A1+2OH-+2Hq=2A102-+3H2T;过滤。⑵将Fe、Cu中Fe溶于溶液中生成硫酸亚铁,因此试剂X是硫酸;溶液A为偏铝酸钠溶液, 向溶液中通入过量二氧化碳,反应生成氢氧化铝沉淀和碳酸氢钠溶液,因此D是碳酸氢钠: 故答案为:稀硫酸(或稀H2so融或硫酸);NaHCOj溶液(或碳酸氢钠溶液)。⑶溶液E在空气中易被氧化,亚铁离子被氧化生成铁离子,铁离子常用KSCN溶液来检验, 因此简单的实验方案检验溶液E是否被氧化的实验为取少量E溶液于试管中,滴入几滴硫 殂化钾溶液,若溶液变为血红色,则说明E溶液已被氧化,反之,则未被氧化:故答案为: 取少量E溶液于试管中,滴入几滴硫犯化钾溶液,若溶液变为血红色,则说明E溶液已被 氧化,反之,则未被氧化。⑷在步骤H时,若用大理石与浓盐酸制取CO?并直接通入溶液A中,一段时间后,观察到 烧杯中产生的白色沉淀会逐渐减少,减少的主要原因是浓盐酸易挥发,挥发出的HC1与沉 淀反应,为避免固体C减少,先用饱和碳酸氢钠溶液除掉挥发的HC1,再通入CO?;故答 案为:在通入CO?之前增加一个盛有饱和NaHCCh溶液的洗气瓶,除去HC1气体:故答案 为:在通入CO?之前增加一个盛有饱和NaHCOs溶液的洗气瓶,除去HC1气体。⑸Fe(OHb与NaClO反应生成NaCl和Na2FeO4,其制取Na2FeO4的离子方程式2Fe(0H)3+3C10一+40H一=2FeOj-+3C「+5Hg:故答案为:2Fe(0H)3+3C10-FOET=2FeO42-4-3Cr+5H2OoD.金属钠密度比煤油或石蜡密度大,钠易与水和氧气反应,因此金属钠保存在液体石蜡或 煤油中,故D正确。综上所述,答案为A。『点睛』氯水中次氯酸见光分解生成氧气和HC1,因此久置氯水颜色变浅,最终变为稀盐酸。3.下列关于胶体的叙述,正确的是()A.在饱和氯化铁溶液中逐滴加入NaOH溶液,可制备氢氧化铁胶体B.明帆净水利用了胶体的吸附性C.电泳现象可以证明胶体带电D.胶体粒子很小,可以透过滤纸和半透膜[答案JBr解析」『详解」A.制备氢氧化铁胶体是向沸水中滴加几滴饱和氯化铁溶液,再加热到出现红褐色, 停止加热,故A错误;B.明机净水利用了胶体的吸附性,故B正确:C.电泳现象可以证明胶体粒子带电荷,故C错误:D.胶体粒子很小,可以透过滤纸,但不能透过半透膜,故D错误。综上所述,答案为B。4.下列实验中,所采取的分离或提纯方法与对应原理都正确的是()r答案」c『解析j『详解J A.乙醉易溶于水,因此乙醉不能作萃取剂,故A错误:B.碳酸氢钠受热易分解,碘易升华,因此分离碳酸氢钠和碘的固体混合物不能用加热方法, 故B错误:C.除去KN03固体中混杂的NaCl,用重结晶方法,主要是NaCl的溶解度随温度变化不大, 故C正确:D.分离花生油和水用分液方法,故D错误。综上所述,答案C。5.设Na表示阿伏加德罗常数,下列叙述正确的是()A. ImolNa在空气中反应后生成Na?O、NazO?混合物,转移的电子数一定为NaB.常温常压下,L8gH9中含有的电子数为0.8NaC.标准状况下,2.24LSO3含有的原子数为0.4NaD. O.lmol L1的FeCb溶液中含有Fe3+的数目为0.1NAr答案」a「解析」『详解』A. Na化合价由0价变为+1价,因此1molNa在空气中反应后生成Na9、NaQ混合物转移的电子数一定为Na,故A正确;m 1.8g八,,B.1个HQ含有10个电子,常温常压下,1.8gH2O物质的量为n=—=———=0.1 mol,M 18g- mol含有的电子数为入么,故B错误:C.标准状况下,SO3是非气态的物质,无法计算物质的量,故C错误:D.FeCb溶液的体积未知,因此无法计算含有Fe3+的数目,故D错误。综上所述,答案为A。6.下列离子可能共存的是()A.在加入铝粉能产生氢气的溶液中:NHJ、Fe3 Cu2 HCO3一B.酸性溶液中:Ba2 AIO2-、K Fe2+C.含大量Fe3+的溶液中:K Na「、SCN一D.某澄清溶液中:K Cu2 SO42-, Mg2+.
某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量AI2O3和F.Ch,为探索 工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、 绿矶晶体(FeS047H:0)和胆矶晶体(CuS045H2O)o
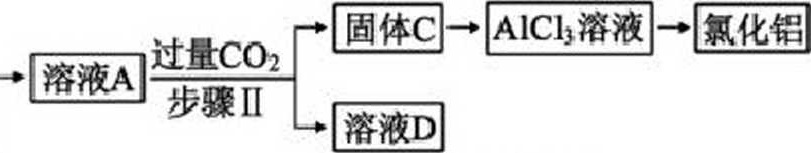
固体F |f |CuSQi溶液一陋研;
请回答:
(1)步骤I中,发生的氧化还原反应的离子方程式为涉及到的分离操作是—o
(2)试剂X是—:溶液D是—。
(3)溶液E在空气中易被氧化,请设计一个简单的实验方案检验溶液E是否被氧化—.
(4)在步骤H时,若用大理石与浓盐酸制取CO?并直接通入溶液A中,一段时间后,观察 到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是一。
(5)工业上常用溶液E制取净水剂NazFeCU,流程如图:
______|Fe(0H)3|NaC10/Na0H |^,Na2FeO4
ii调pH’______混合溶液’写出由Fe(OH)3制取Na2FeO4的离子方程式_。(已知NaClO还原为NaCl)
「答案J(I). 2A1+2OH +2H2O=2A1O2+3H2T(2).过滤(3).稀硫酸(或稀H2so』;或
硫酸)(4).NaHCO3溶液(或碳酸氢钠溶液)(5).取少量E溶液于试管中,滴入几
滴硫河化钾溶液,若溶液变为血红色,则说明E溶液已被氧化,反之,则未被氧化(6).在 通入C02之前增加一个盛有饱和NaHCOs溶液的洗气瓶,除去HC1气体(7). 2Fe(0H)3+3C10+40H =2FeO42+3Cr+5H2O
「解析」
1分析」Cu、Fe和Al,少量AlzOs和FezOj,氢氧化钠与Al、AhO3反应,而Cu、Fe和Fe2O3不反应,过滤得到滤渣为Cu、Fe和Fe2O3,滤液为偏铝酸钠溶液和氢氧化钠溶液,向滤液 中通入过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠溶液,过滤,向沉淀中加入盐酸生成 氯化铝溶液,最终得到氯化铝固体:向灌渣为Cu、Fe和FezCh中加入稀硫酸,生成硫酸亚 铁,最终得到绿矶,过滤得到Cu, Cu与氧气、硫酸反应得到硫酸铜。
『详解J⑴步骤I中,发生的氧化还原反应的是铝和氢氧化钠反应生成偏铝酸钠和氢气,K离子方程式为2A1+2OET+2H20=2A10d+3H2T,Fe、Cu、FezCh不和氢氧化钠溶液反应,因 此涉及到的分离操作是过滤;故答案为:2A1+2OH-+2Hq=2A102-+3H2T;过滤。
⑵将Fe、Cu中Fe溶于溶液中生成硫酸亚铁,因此试剂X是硫酸;溶液A为偏铝酸钠溶液, 向溶液中通入过量二氧化碳,反应生成氢氧化铝沉淀和碳酸氢钠溶液,因此D是碳酸氢钠: 故答案为:稀硫酸(或稀H2so融或硫酸);NaHCOj溶液(或碳酸氢钠溶液)。
⑶溶液E在空气中易被氧化,亚铁离子被氧化生成铁离子,铁离子常用KSCN溶液来检验, 因此简单的实验方案检验溶液E是否被氧化的实验为取少量E溶液于试管中,滴入几滴硫 殂化钾溶液,若溶液变为血红色,则说明E溶液已被氧化,反之,则未被氧化:故答案为: 取少量E溶液于试管中,滴入几滴硫犯化钾溶液,若溶液变为血红色,则说明E溶液已被 氧化,反之,则未被氧化。
⑷在步骤H时,若用大理石与浓盐酸制取CO?并直接通入溶液A中,一段时间后,观察到 烧杯中产生的白色沉淀会逐渐减少,减少的主要原因是浓盐酸易挥发,挥发出的HC1与沉 淀反应,为避免固体C减少,先用饱和碳酸氢钠溶液除掉挥发的HC1,再通入CO?;故答 案为:在通入CO?之前增加一个盛有饱和NaHCCh溶液的洗气瓶,除去HC1气体:故答案 为:在通入CO?之前增加一个盛有饱和NaHCOs溶液的洗气瓶,除去HC1气体。
⑸Fe(OHb与NaClO反应生成NaCl和Na2FeO4,其制取Na2FeO4的离子方程式2Fe(0H)3+3C10一+40H一=2FeOj-+3C「+5Hg:故答案为:2Fe(0H)3+3C10-FOET=2FeO42-4-3Cr+5H2Oo
D.金属钠密度比煤油或石蜡密度大,钠易与水和氧气反应,因此金属钠保存在液体石蜡或 煤油中,故D正确。
综上所述,答案为A。
『点睛』氯水中次氯酸见光分解生成氧气和HC1,因此久置氯水颜色变浅,最终变为稀盐酸。
3.下列关于胶体的叙述,正确的是()
A.在饱和氯化铁溶液中逐滴加入NaOH溶液,可制备氢氧化铁胶体
B.明帆净水利用了胶体的吸附性
C.电泳现象可以证明胶体带电
D.胶体粒子很小,可以透过滤纸和半透膜
[答案JB
r解析」
『详解」A.制备氢氧化铁胶体是向沸水中滴加几滴饱和氯化铁溶液,再加热到出现红褐色, 停止加热,故A错误;
B.明机净水利用了胶体的吸附性,故B正确:
C.电泳现象可以证明胶体粒子带电荷,故C错误:
D.胶体粒子很小,可以透过滤纸,但不能透过半透膜,故D错误。
综上所述,答案为B。
4.下列实验中,所采取的分离或提纯方法与对应原理都正确的是()
r答案」c
『解析j
『详解J A.乙醉易溶于水,因此乙醉不能作萃取剂,故A错误:
B.碳酸氢钠受热易分解,碘易升华,因此分离碳酸氢钠和碘的固体混合物不能用加热方法, 故B错误:
C.除去KN03固体中混杂的NaCl,用重结晶方法,主要是NaCl的溶解度随温度变化不大, 故C正确:
D.分离花生油和水用分液方法,故D错误。
综上所述,答案C。
5.设Na表示阿伏加德罗常数,下列叙述正确的是()
A. ImolNa在空气中反应后生成Na?O、NazO?混合物,转移的电子数一定为Na
B.常温常压下,L8gH9中含有的电子数为0.8Na
C.标准状况下,2.24LSO3含有的原子数为0.4Na
D. O.lmol L1的FeCb溶液中含有Fe3+的数目为0.1NA
r答案」a
「解析」
『详解』A. Na化合价由0价变为+1价,因此1molNa在空气中反应后生成Na9、NaQ
混合物转移的电子数一定为Na,故A正确;
m 1.8g八,,
B.1个HQ含有10个电子,常温常压下,1.8gH2O物质的量为n=—=———=0.1 mol,
M 18g- mol
含有的电子数为入么,故B错误:
C.标准状况下,SO3是非气态的物质,无法计算物质的量,故C错误:
D.FeCb溶液的体积未知,因此无法计算含有Fe3+的数目,故D错误。
综上所述,答案为A。
6.下列离子可能共存的是()
A.在加入铝粉能产生氢气的溶液中:NHJ、Fe3 Cu2 HCO3一
B.酸性溶液中:Ba2 AIO2-、K Fe2+
C.含大量Fe3+的溶液中:K Na「、SCN一
D.某澄清溶液中:K Cu2 SO42-, Mg2+
.题目解答
答案
i H2O2. r固体I
.