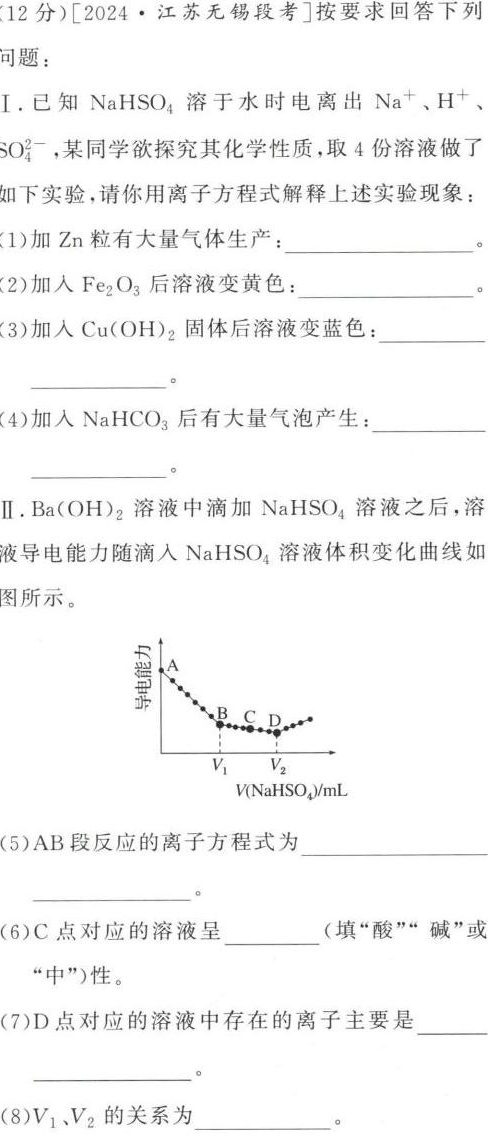
(12分)[2024·江苏无锡段考]按要求回答下列-|||-问题:-|||-I.已知NaHSO4溶于水时电离出 ^+ 、^+ 、-|||-(S{O)_(4)}^2- ,某同学欲探究其化学性质,取4份溶液做了-|||-如下实验,请你用离子方程式解释上述实验现象:-|||-(1)加Zn粒有大量气体生产: __-|||-(2)加入Fe2O3后溶液变黄色: __ _。-|||-(3)加入Cu(OH)2固体后溶液变蓝色: __-|||-__-|||-(4)加入NaHCO3后有大量气泡产生: __-|||-__ o-|||-Ⅱ.Ba(OH)2溶液中滴加NaHSO4溶液之后,溶-|||-液导电能力随滴入NaHSO4溶液体积变化曲线如-|||-图所示。-|||-B C D-|||-V1 V2-|||-(NaHS(O)_(4))/mL-|||-(5)AB段反应的离子方程式为 __-|||-__ _。-|||-(6)C点对应的溶液呈 __ (填"酸""碱"或-|||-"中")性。-|||-(7)D点对应的溶液中存在的离子主要是 __-|||-__ o-|||-(8)V1、V2的关系为 __
题目解答
答案

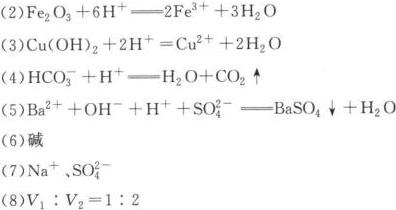
解析
考查要点:本题主要考查强酸性盐的性质及复分解反应的离子方程式书写,同时涉及溶液导电性变化与反应进程的关系分析。
解题思路:
- I部分:NaHSO4在溶液中完全电离为$Na^+$、$H^+$、$SO_4^{2-}$,其化学性质类似于硫酸。需根据各反应物与$H^+$、$SO_4^{2-}$的反应规律书写离子方程式。
- II部分:Ba(OH)2与NaHSO4反应生成BaSO4沉淀和水,需结合导电性变化判断反应阶段及过量情况,分析溶液中剩余离子的组成。
破题关键:
- 强酸性盐的酸性本质:NaHSO4溶液中$H^+$的存在是反应的核心。
- 导电性变化规律:离子浓度减少(沉淀生成)导致导电性下降,离子浓度回升(过量试剂电离)导致导电性恢复。
I. 探究NaHSO4的化学性质
(1) 加Zn粒产生气体
关键反应:金属Zn与$H^+$发生置换反应生成$H_2$。
离子方程式:
$Zn + 2H^+ \rightarrow Zn^{2+} + H_2 \uparrow$
(2) 加入Fe₂O₃后溶液变黄色
关键反应:Fe₂O₃与酸反应生成$Fe^{3+}$。
离子方程式:
$Fe_2O_3 + 6H^+ \rightarrow 2Fe^{3+} + 3H_2O$
(3) 加入Cu(OH)₂固体后溶液变蓝色
关键反应:$Cu(OH)_2$与酸反应生成$Cu^{2+}$。
离子方程式:
$Cu(OH)_2 + 2H^+ \rightarrow Cu^{2+} + 2H_2O$
(4) 加入NaHCO₃产生气泡
关键反应:$HCO_3^-$与$H^+$反应生成$CO_2$。
离子方程式:
$HCO_3^- + H^+ \rightarrow H_2O + CO_2 \uparrow$
II. Ba(OH)₂与NaHSO₄反应分析
(5) AB段反应的离子方程式
关键反应:Ba²⁺与$SO_4^{2-}$生成BaSO4沉淀,同时$H^+$与OH⁻中和。
离子方程式:
$Ba^{2+} + OH^- + H^+ + SO_4^{2-} \rightarrow BaSO_4 \downarrow + H_2O$
(6) C点溶液的酸碱性
关键分析:C点导电性最低,说明反应完全,溶液中剩余$Na^+$和$SO_4^{2-}$,呈中性。
(7) D点溶液中存在的主要离子
关键分析:D点导电性回升,说明NaHSO4过量,溶液中主要离子为$Na^+$和$SO_4^{2-}$。
(8) V₁与V₂的关系
关键分析:Ba(OH)₂与NaHSO4的物质的量比为1:1,但Ba(OH)₂提供2个OH⁻,需2倍NaHSO4中和,故$V_1:V_2 = 1:2$。