题目
在一恒容反应器中进行下列液相反应: +Barrow R _(R)=1.6(C)_(A)kmol/(m)^3.h-|||-arrow D rn=8.2C^2kmol/m^3.h-|||-式中r,n,n0分别表示产物R及D的生成速率。反应用的原料为A与B-|||-的混合物,其中A的浓度为 /(m)^5, 试计算A的转化率达到95%时-|||-所需的反应时间。
在一恒容反应器中进行下列液相反应: 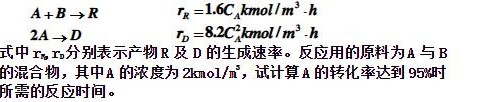
题目解答
答案

解析
步骤 1:确定反应速率
反应物A的消耗速率应为两反应速率之和,即
$$
R_A = r_R + 2r_D = 1.6C_A + 16.4C_A^2 = 1.6C_A(1 + 10.25C_A)
$$
步骤 2:建立微分方程
利用反应速率与浓度变化的关系,可以得到
$$
-\frac{dC_A}{dt} = 1.6C_A(1 + 10.25C_A)
$$
步骤 3:积分求解
对上述微分方程进行积分,得到
$$
1.6t = \int_{C_{A0}}^{C_A} \frac{dC_A}{C_A(1 + 10.25C_A)}
$$
步骤 4:计算积分
积分结果为
$$
1.6t = \left[ \ln\left( \frac{C_A}{C_{A0}} \right) + \ln\left( \frac{1 + 10.25C_A}{1 + 10.25C_{A0}} \right) \right]
$$
步骤 5:代入初始条件和转化率
已知初始浓度 $C_{A0} = 2 kmol/m^3$,转化率 $x = 0.95$,则 $C_A = C_{A0}(1 - x) = 0.1 kmol/m^3$,代入上式得
$$
1.6t = \ln\left( \frac{0.1}{2} \right) + \ln\left( \frac{1 + 10.25 \times 0.1}{1 + 10.25 \times 2} \right)
$$
步骤 6:计算时间
计算得到
$$
t = \frac{1}{1.6} \left[ \ln\left( \frac{0.1}{2} \right) + \ln\left( \frac{1 + 10.25 \times 0.1}{1 + 10.25 \times 2} \right) \right] = 0.4038 h
$$
反应物A的消耗速率应为两反应速率之和,即
$$
R_A = r_R + 2r_D = 1.6C_A + 16.4C_A^2 = 1.6C_A(1 + 10.25C_A)
$$
步骤 2:建立微分方程
利用反应速率与浓度变化的关系,可以得到
$$
-\frac{dC_A}{dt} = 1.6C_A(1 + 10.25C_A)
$$
步骤 3:积分求解
对上述微分方程进行积分,得到
$$
1.6t = \int_{C_{A0}}^{C_A} \frac{dC_A}{C_A(1 + 10.25C_A)}
$$
步骤 4:计算积分
积分结果为
$$
1.6t = \left[ \ln\left( \frac{C_A}{C_{A0}} \right) + \ln\left( \frac{1 + 10.25C_A}{1 + 10.25C_{A0}} \right) \right]
$$
步骤 5:代入初始条件和转化率
已知初始浓度 $C_{A0} = 2 kmol/m^3$,转化率 $x = 0.95$,则 $C_A = C_{A0}(1 - x) = 0.1 kmol/m^3$,代入上式得
$$
1.6t = \ln\left( \frac{0.1}{2} \right) + \ln\left( \frac{1 + 10.25 \times 0.1}{1 + 10.25 \times 2} \right)
$$
步骤 6:计算时间
计算得到
$$
t = \frac{1}{1.6} \left[ \ln\left( \frac{0.1}{2} \right) + \ln\left( \frac{1 + 10.25 \times 0.1}{1 + 10.25 \times 2} \right) \right] = 0.4038 h
$$