题目
15-10 当下述电池中的溶液是pH等于4.00的缓冲溶液时,在25℃时用毫伏计测得下列电池的电动-|||-势为0.209V:-|||-玻璃电极 |(H)^+(a=x)| 饱和甘汞电极-|||-当缓冲溶液由三种未知溶液代替时,毫伏计读数如下:(1)0.312 V;(2)0.088V;(3) -0.017W,-|||-试计算每种未知溶液的pH。

题目解答
答案
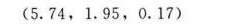
解析
步骤 1:确定电池电动势与pH的关系
电池电动势E与pH的关系可以表示为:$E = E_0 + \frac{0.0591}{n} \log \frac{a_{H^+}}{a_{H^+}^{ref}}$,其中$E_0$是标准电动势,$n$是电子转移数,$a_{H^+}$是未知溶液中氢离子的活度,$a_{H^+}^{ref}$是参考溶液中氢离子的活度。对于玻璃电极,$n=1$,$a_{H^+}^{ref}=10^{-4}$,因为参考溶液的pH为4.00。
步骤 2:计算未知溶液的pH
对于每种未知溶液,我们已知电池电动势E,可以使用上述公式计算未知溶液的pH。首先,将已知的电动势值代入公式,然后解出未知溶液的pH值。
步骤 3:计算每种未知溶液的pH
对于每种未知溶液,我们已知电池电动势E,可以使用上述公式计算未知溶液的pH。首先,将已知的电动势值代入公式,然后解出未知溶液的pH值。
电池电动势E与pH的关系可以表示为:$E = E_0 + \frac{0.0591}{n} \log \frac{a_{H^+}}{a_{H^+}^{ref}}$,其中$E_0$是标准电动势,$n$是电子转移数,$a_{H^+}$是未知溶液中氢离子的活度,$a_{H^+}^{ref}$是参考溶液中氢离子的活度。对于玻璃电极,$n=1$,$a_{H^+}^{ref}=10^{-4}$,因为参考溶液的pH为4.00。
步骤 2:计算未知溶液的pH
对于每种未知溶液,我们已知电池电动势E,可以使用上述公式计算未知溶液的pH。首先,将已知的电动势值代入公式,然后解出未知溶液的pH值。
步骤 3:计算每种未知溶液的pH
对于每种未知溶液,我们已知电池电动势E,可以使用上述公式计算未知溶液的pH。首先,将已知的电动势值代入公式,然后解出未知溶液的pH值。