题目
某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。干燥的Cl2 铜粉-|||-A 空试管 水 紫色石AgNO3NaOH-|||-B C 蕊溶液 溶液 溶液-|||-D E F已知:该装置气密性良好,铜粉放在耐高温托盘内(托盘不与氯气反应,防止硬质玻璃管炸裂)。请回答下列问题:(1)A中发生的化学反应方程式为 ____ ;为防止铜与空气中的氧气反应,在加热之前应该进行的操作为 ____ 。(2)B装置中空试管的作用是 ____ 。(3)实验中,观察到D中颜色的变化为 ____ 。(4)当观察到E装置中AgNO3溶液中出现 ____ (填实验现象)时,点燃酒精灯加热;写出AgNO3溶液中发生反应的化学方程式: ____ 、 ____ 。(5)F中氢氧化钠溶液的作用是 ____ ,发生反应的离子方程式为 ____ 。
某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。
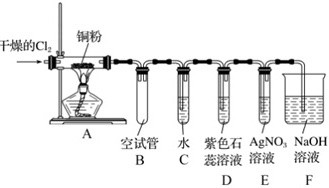
已知:该装置气密性良好,铜粉放在耐高温托盘内(托盘不与氯气反应,防止硬质玻璃管炸裂)。请回答下列问题:
(1)A中发生的化学反应方程式为 ____ ;为防止铜与空气中的氧气反应,在加热之前应该进行的操作为 ____ 。
(2)B装置中空试管的作用是 ____ 。
(3)实验中,观察到D中颜色的变化为 ____ 。
(4)当观察到E装置中AgNO3溶液中出现 ____ (填实验现象)时,点燃酒精灯加热;写出AgNO3溶液中发生反应的化学方程式: ____ 、 ____ 。
(5)F中氢氧化钠溶液的作用是 ____ ,发生反应的离子方程式为 ____ 。

已知:该装置气密性良好,铜粉放在耐高温托盘内(托盘不与氯气反应,防止硬质玻璃管炸裂)。请回答下列问题:
(1)A中发生的化学反应方程式为 ____ ;为防止铜与空气中的氧气反应,在加热之前应该进行的操作为 ____ 。
(2)B装置中空试管的作用是 ____ 。
(3)实验中,观察到D中颜色的变化为 ____ 。
(4)当观察到E装置中AgNO3溶液中出现 ____ (填实验现象)时,点燃酒精灯加热;写出AgNO3溶液中发生反应的化学方程式: ____ 、 ____ 。
(5)F中氢氧化钠溶液的作用是 ____ ,发生反应的离子方程式为 ____ 。
题目解答
答案
解:(1)A中发生的化学反应方程式为Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;为防止铜与空气中的氧气反应,在加热之前应该进行的操作为向装置中通入氯气,
故答案为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;向装置中通入氯气;
(2)B装置中空试管的作用是防倒吸,
故答案为:防倒吸;
(3)D中Cl2和水反应生成HCl、HClO,紫色石蕊试液遇酸变红色,HClO使溶液褪色,所以实验中观察到D中颜色的变化为先变红色后褪色,
故答案为:先变红色后褪色;
(4)E中氯气和水反应生成HCl能和AgNO3溶液反应生成AgCl白色沉淀,所以当观察到E装置中AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;AgNO3溶液中发生反应的化学方程式:Cl2+H2O=HCl+HClO、AgNO3+HCl=AgCl↓+HNO3,
故答案为:生成白色沉淀;Cl2+H2O=HCl+HClO;AgNO3+HCl=AgCl↓+HNO3;
(5)F中氢氧化钠溶液的作用是处理尾气,发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:处理尾气;Cl2+2OH-=Cl-+ClO-+H2O。
故答案为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;向装置中通入氯气;
(2)B装置中空试管的作用是防倒吸,
故答案为:防倒吸;
(3)D中Cl2和水反应生成HCl、HClO,紫色石蕊试液遇酸变红色,HClO使溶液褪色,所以实验中观察到D中颜色的变化为先变红色后褪色,
故答案为:先变红色后褪色;
(4)E中氯气和水反应生成HCl能和AgNO3溶液反应生成AgCl白色沉淀,所以当观察到E装置中AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;AgNO3溶液中发生反应的化学方程式:Cl2+H2O=HCl+HClO、AgNO3+HCl=AgCl↓+HNO3,
故答案为:生成白色沉淀;Cl2+H2O=HCl+HClO;AgNO3+HCl=AgCl↓+HNO3;
(5)F中氢氧化钠溶液的作用是处理尾气,发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:处理尾气;Cl2+2OH-=Cl-+ClO-+H2O。
解析
本题以探究氯气的化学性质实验装置为载体,考查以下核心内容:
- 铜与氯气反应的条件及产物:需注意反应条件为加热,且需排除氧气干扰;
- 防倒吸装置的作用:理解空试管在实验中的关键作用;
- 氯水的性质验证:通过石蕊试液颜色变化体现酸性和漂白性;
- 实验操作的逻辑顺序:通过AgNO₃溶液中现象判断何时开始加热;
- 尾气处理的必要性及反应原理:明确NaOH溶液的作用及对应离子方程式。
第(1)题
反应方程式
铜在加热条件下与干燥的Cl₂反应生成CuCl₂,方程式为:
$\text{Cu} + \text{Cl}_2 \xrightarrow{\Delta} \text{CuCl}_2$
防止氧化操作
实验前需通入Cl₂,排出装置内空气,避免铜与氧气反应。
第(2)题
防倒吸作用
B装置中空试管通过物理隔断,防止后续装置中的液体倒吸入反应管,保护反应装置。
第(3)题
石蕊试液变化
Cl₂溶于水生成HCl和HClO:
$\text{Cl}_2 + \text{H}_2\text{O} \rightleftharpoons \text{HCl} + \text{HClO}$
HCl使溶液显酸性(变红),HClO具有漂白性(褪色),故现象为先变红后褪色。
第(4)题
观察现象
当E中AgNO₃溶液出现白色沉淀(AgCl),说明Cl₂已干燥,此时点燃酒精灯加热A装置。
反应方程式
- Cl₂与水反应:
$\text{Cl}_2 + \text{H}_2\text{O} \rightleftharpoons \text{HCl} + \text{HClO}$ - HCl与AgNO₃反应:
$\text{AgNO}_3 + \text{HCl} \rightarrow \text{AgCl} \downarrow + \text{HNO}_3$
第(5)题
尾气处理作用
F中NaOH溶液用于吸收未反应的Cl₂,防止污染。
离子方程式
$\text{Cl}_2 + 2\text{OH}^- \rightarrow \text{Cl}^- + \text{ClO}^- + \text{H}_2\text{O}$