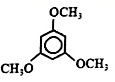
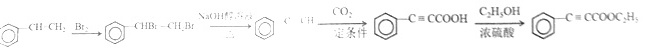(8分)Hagrmann酯(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):=CH 催化剂B CH3OH (H)_(2)=CH-C=C(H)_(2)-|||-OCH3-|||-QCH3-|||-A C-|||-催化剂-|||-(H)_(3)Cequiv CH 一 定条件 E-|||-CO2 CH3CH2OH → (H)_(3)Cequiv CCOOC(H)_(2)C(H)_(3)--|||-CH3-|||-COOCH2CH3 1 CH3-|||-D 浓H2SO4,△ F COOCH2CH -3-|||-G H(1)H的分子式是___;D的名称是____(2)G中含氧官能团的名称是___;已知B的分子式为C4H4,则A→B的反应类型是_____(3)E→F的化学方程式是_____(4)下列说法正确的是___a.A能和HCl反应得到聚氯乙烯的单体b.H的同分异构体中不可能存在芳香族化合物c.B、C、D均可发生加聚反应d.1molF与足量H2反应可消耗3molH2(5)M是G的同系物且相对分子量比G小28,请写出满足下列条件的M的同分异构体的结构简式____①苯环上的一氯取代只有一种 ②不能与金属钠反应放出H2C.加成反应,取代反应 D.还原反应,消去反应19.(6分)已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1 C.+45.2 kJ·mol-1 D.+69.4 kJ·mol-120.(6分)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断不正确的是A.生成44.8L N2(标准状况)B.有0.25 mol KNO3被还原C.转移电子的物质的量为1.75molD.被氧化的N原子的物质的量为3.75mol.
(8分)Hagrmann酯(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):
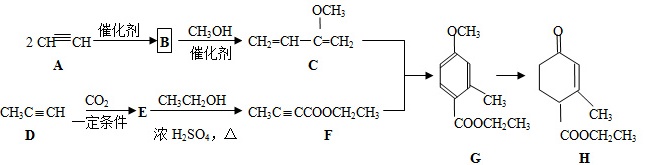
(1)H的分子式是___;D的名称是____
(2)G中含氧官能团的名称是___;已知B的分子式为C4H4,则A→B的反应类型是_____
(3)E→F的化学方程式是_____
(4)下列说法正确的是___
a.A能和HCl反应得到聚氯乙烯的单体
b.H的同分异构体中不可能存在芳香族化合物
c.B、C、D均可发生加聚反应
d.1molF与足量H2反应可消耗3molH2
(5)M是G的同系物且相对分子量比G小28,请写出满足下列条件的M的同分异构体的结构简式____
①苯环上的一氯取代只有一种 ②不能与金属钠反应放出H2
C.加成反应,取代反应 D.还原反应,消去反应
19.(6分)已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1 C.+45.2 kJ·mol-1 D.+69.4 kJ·mol-1
20.(6分)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断不正确的是
A.生成44.8L N2(标准状况)
B.有0.25 mol KNO3被还原
C.转移电子的物质的量为1.75mol
D.被氧化的N原子的物质的量为3.75mol
.题目解答
答案
C10H14O3 丙炔 醚键、酯基 加成反应 CH3C≡C-COOH+C2H5OH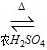 CH3C≡C-COOC2H5+H2O a、c
CH3C≡C-COOC2H5+H2O a、c