题目
7-22 已知 ((Cu)^2+/(Cu)^+)=0.1607W, ((Cu)^2+/CuI)=0.866V,-|||-Ksp(CuI)为 () 。-|||-A. https:/img.zuoyebang.cc/zyb_f7c1d0a79c5f68b7db0494671a29ac61.jpg.2times (10)^-6 B. .3times (10)^-18 C. https:/img.zuoyebang.cc/zyb_f7c1d0a79c5f68b7db0494671a29ac61.jpg.2times (10)^-24 D. https:/img.zuoyebang.cc/zyb_f7c1d0a79c5f68b7db0494671a29ac61.jpg.2times (10)^-12
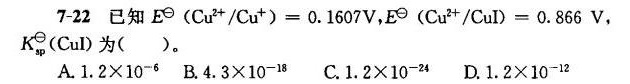
题目解答
答案
解析
步骤 1:确定电极电势和标准电极电势
已知 ${E}^{\theta }({Cu}^{2+}/{Cu}^{+})=0.1607V$ 和 ${E}^{\theta }({Cu}^{2+}/CuI)=0.866V$,这两个电极电势分别对应于铜离子的氧化还原反应和铜离子与碘离子的反应。
步骤 2:应用能斯特方程
根据能斯特方程,电极电势与标准电极电势之间的关系为:
\[ E = E^{\theta} - \frac{RT}{nF} \ln Q \]
其中,$E$ 是电极电势,$E^{\theta}$ 是标准电极电势,$R$ 是气体常数,$T$ 是温度,$n$ 是电子转移数,$F$ 是法拉第常数,$Q$ 是反应商。
步骤 3:计算反应商
对于反应 $Cu^{2+} + I^- \rightarrow CuI + Cu^+$,反应商 $Q$ 可以表示为:
\[ Q = \frac{[Cu^+]}{[Cu^{2+}][I^-]} \]
由于 $CuI$ 是固体,其浓度视为常数,可以忽略。
步骤 4:计算溶度积常数
根据标准电极电势和能斯特方程,可以计算出反应商 $Q$,进而得到溶度积常数 $K_{sp}$。溶度积常数 $K_{sp}$ 与反应商 $Q$ 的关系为:
\[ K_{sp} = [Cu^{2+}][I^-] \]
根据已知的电极电势,可以计算出 $K_{sp}$ 的值。
步骤 5:选择正确的选项
根据计算结果,选择正确的选项。
已知 ${E}^{\theta }({Cu}^{2+}/{Cu}^{+})=0.1607V$ 和 ${E}^{\theta }({Cu}^{2+}/CuI)=0.866V$,这两个电极电势分别对应于铜离子的氧化还原反应和铜离子与碘离子的反应。
步骤 2:应用能斯特方程
根据能斯特方程,电极电势与标准电极电势之间的关系为:
\[ E = E^{\theta} - \frac{RT}{nF} \ln Q \]
其中,$E$ 是电极电势,$E^{\theta}$ 是标准电极电势,$R$ 是气体常数,$T$ 是温度,$n$ 是电子转移数,$F$ 是法拉第常数,$Q$ 是反应商。
步骤 3:计算反应商
对于反应 $Cu^{2+} + I^- \rightarrow CuI + Cu^+$,反应商 $Q$ 可以表示为:
\[ Q = \frac{[Cu^+]}{[Cu^{2+}][I^-]} \]
由于 $CuI$ 是固体,其浓度视为常数,可以忽略。
步骤 4:计算溶度积常数
根据标准电极电势和能斯特方程,可以计算出反应商 $Q$,进而得到溶度积常数 $K_{sp}$。溶度积常数 $K_{sp}$ 与反应商 $Q$ 的关系为:
\[ K_{sp} = [Cu^{2+}][I^-] \]
根据已知的电极电势,可以计算出 $K_{sp}$ 的值。
步骤 5:选择正确的选项
根据计算结果,选择正确的选项。