题目
聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。Ⅰ.苯乙烯的制备(1)已知下列反应的热化学方程式:①C6H5C2H5(g)+((21))/(2)O2(g)═8CO2(g)+5H2O(g)ΔH1=-4386.9kJ•mol-1②C6H5CH=CH2(g)+10O2(g)═8CO2(g)+4H2O(g)ΔH2=-4263.1kJ•mol-1③H2(g)+(1)/(2)O2(g)═H2O(g)ΔH3=-241.8kJ•mol-1计算反应④C6H5C2H5(g)⇌C6H5CH=CH2(g)+H2(g)的ΔH4= ____ kJ•mol-1;(2)在某温度、100kPa下,向反应器中充入1mol气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入 ____ mol水蒸气作为稀释气(计算时忽略副反应);(3)在913K、100kPa下,以水蒸气作稀释气、Fe2O3作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:⑤C6H5C2H5(g)⇌C6H6(g)+CH2=CH2(g)⑥C6H5C2H5(g)+H2(g)⇌C6H5CH3(g)+CH4(g)以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S(S=(转化为目的产物所消耗乙苯的量)/(已转化的乙苯总量)×100%)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是 ____ ,理由是 ____ ;94-|||-92-|||-90--|||-6- b-|||-4--|||-2-|||-0--|||-50 55 65 75 85-|||-乙苯转化率/%(4)关于本反应体系中催化剂Fe2O3的描述错误的是 ____ ;A.X射线衍射技术可测定Fe2O3晶体结构B.Fe2O3可改变乙苯平衡转化率C.Fe2O3降低了乙苯脱氢反应的活化能D.改变Fe2O3颗粒大小不影响反应速率Ⅱ.苯乙烯的聚合苯乙烯聚合有多种方法,其中一种方法的关键步骤是某Cu(Ⅰ)的配合物促进C6H5CH2X(引发剂,X表示卤素)生成自由基C6H5stackrel(•)(C)H2,实现苯乙烯可控聚合。(5)引发剂C6H5CH2Cl、C6H5CH2Br、C6H5CH2I中活性最高的是 ____ ;(6)室温下,①Cu+在配体L的水溶液中形成[Cu(L)2]+,其反应平衡常数为K;②CuBr在水中的溶度积常数为Ksp。由此可知,CuBr在配体L的水溶液中溶解反应的平衡常数为 ____ (所有方程式中计量系数关系均为最简整数比)。
聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①C6H5C2H5(g)+$\frac{{21}}{2}$O2(g)═8CO2(g)+5H2O(g)ΔH1=-4386.9kJ•mol-1
②C6H5CH=CH2(g)+10O2(g)═8CO2(g)+4H2O(g)ΔH2=-4263.1kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)ΔH3=-241.8kJ•mol-1
计算反应④C6H5C2H5(g)⇌C6H5CH=CH2(g)+H2(g)的ΔH4= ____ kJ•mol-1;
(2)在某温度、100kPa下,向反应器中充入1mol气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入 ____ mol水蒸气作为稀释气(计算时忽略副反应);
(3)在913K、100kPa下,以水蒸气作稀释气、Fe2O3作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
⑤C6H5C2H5(g)⇌C6H6(g)+CH2=CH2(g)
⑥C6H5C2H5(g)+H2(g)⇌C6H5CH3(g)+CH4(g)
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S(S=$\frac{转化为目的产物所消耗乙苯的量}{已转化的乙苯总量}$×100%)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是 ____ ,理由是 ____ ;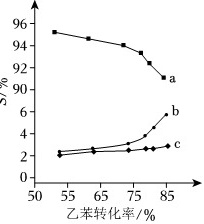
(4)关于本反应体系中催化剂Fe2O3的描述错误的是 ____ ;
A.X射线衍射技术可测定Fe2O3晶体结构
B.Fe2O3可改变乙苯平衡转化率
C.Fe2O3降低了乙苯脱氢反应的活化能
D.改变Fe2O3颗粒大小不影响反应速率
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某Cu(Ⅰ)的配合物促进C6H5CH2X(引发剂,X表示卤素)生成自由基C6H5$\stackrel{•}{C}$H2,实现苯乙烯可控聚合。
(5)引发剂C6H5CH2Cl、C6H5CH2Br、C6H5CH2I中活性最高的是 ____ ;
(6)室温下,①Cu+在配体L的水溶液中形成[Cu(L)2]+,其反应平衡常数为K;
②CuBr在水中的溶度积常数为Ksp。由此可知,CuBr在配体L的水溶液中溶解反应的平衡常数为 ____ (所有方程式中计量系数关系均为最简整数比)。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①C6H5C2H5(g)+$\frac{{21}}{2}$O2(g)═8CO2(g)+5H2O(g)ΔH1=-4386.9kJ•mol-1
②C6H5CH=CH2(g)+10O2(g)═8CO2(g)+4H2O(g)ΔH2=-4263.1kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)ΔH3=-241.8kJ•mol-1
计算反应④C6H5C2H5(g)⇌C6H5CH=CH2(g)+H2(g)的ΔH4= ____ kJ•mol-1;
(2)在某温度、100kPa下,向反应器中充入1mol气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入 ____ mol水蒸气作为稀释气(计算时忽略副反应);
(3)在913K、100kPa下,以水蒸气作稀释气、Fe2O3作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
⑤C6H5C2H5(g)⇌C6H6(g)+CH2=CH2(g)
⑥C6H5C2H5(g)+H2(g)⇌C6H5CH3(g)+CH4(g)
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S(S=$\frac{转化为目的产物所消耗乙苯的量}{已转化的乙苯总量}$×100%)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是 ____ ,理由是 ____ ;

(4)关于本反应体系中催化剂Fe2O3的描述错误的是 ____ ;
A.X射线衍射技术可测定Fe2O3晶体结构
B.Fe2O3可改变乙苯平衡转化率
C.Fe2O3降低了乙苯脱氢反应的活化能
D.改变Fe2O3颗粒大小不影响反应速率
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某Cu(Ⅰ)的配合物促进C6H5CH2X(引发剂,X表示卤素)生成自由基C6H5$\stackrel{•}{C}$H2,实现苯乙烯可控聚合。
(5)引发剂C6H5CH2Cl、C6H5CH2Br、C6H5CH2I中活性最高的是 ____ ;
(6)室温下,①Cu+在配体L的水溶液中形成[Cu(L)2]+,其反应平衡常数为K;
②CuBr在水中的溶度积常数为Ksp。由此可知,CuBr在配体L的水溶液中溶解反应的平衡常数为 ____ (所有方程式中计量系数关系均为最简整数比)。
题目解答
答案
解:(1)根据盖斯定律:①-②-③计算C6H5C2H5(g)⇌C6H3CH=CH2(g)+H2(g)的ΔH4=-4386.9kJ•mol-1-(-4263.1kJ•mol-1)-(-241.8kJ•mol-1)=+118kJ/mol,
故答案为:+118;
(2)反应④为C6H5C2H5(g)⇌C6H3CH=CH2(g)+H2(g),乙苯的平衡转化率为50%,则平衡时n(C6H5C2H5)=n(C6H3CH=CH2)=n(H2)=0.5mol,平衡分压p(C6H5C2H5)=p(C6H3CH=CH2)=p(H2)=$\frac{0.5mol}{0.5mol+0.5mol+0.5mol}$×100kPa=$\frac{100}{3}$kPa,该温度下的平衡常数Kp=$\frac{p(C{}_{6}H{}_{3}CH=CH{}_{2})•p(H{}_{2})}{p(C{}_{6}H{}_{5}C{}_{2}H{}_{5})}$=$\frac{100}{3}$,乙苯的平衡转化率为75%时,n(C6H5C2H5)=1mol×(1-75%)=0.25mol,n(C6H3CH=CH2)=n(H2)=0.75mol,设恒温恒压条件下充入xmol水蒸气作为稀释气,则平衡分压p(C6H5C2H5)=$\frac{0.25mol}{0.25mol+0.75mol+0.75mol+xmol}$100kPa=$\frac{25}{1.75+x}$kPa,p(C6H3CH=CH2)=p(H2)=3p(C6H5C2H5)=$\frac{75}{1.75+x}$kPa,该温度下Kp不变,即$\frac{\frac{75}{1.75+x}×\frac{75}{1.75+x}}{\frac{25}{1.75+x}}$=$\frac{100}{3}$,解得x=5,
故答案为:5;
(3)反应④的生成物H2是反应⑥进行的反应物,反应⑥生成甲苯的同时消耗H2,促进反应④生成苯乙烯的同时生成更多H2,导致反应④⑥选择性增大的同时,反应④的选择性增加更大,所以曲线b表示苯乙烯的选择性S随乙苯转化率的变化曲线,
故答案为:苯乙烯;生成苯乙烯的同时生成H2,而H2是生成甲苯的原料,所以当甲苯产率增加时,苯乙烯产量增加更多;
(4)A.X射线衍射实验是鉴别晶体与非晶体以及测定晶体结构的最可靠的途径,该技术可测定Fe2O3晶体结构,故A正确;
B.Fe2O3是乙苯除脱氢生成苯乙烯的催化剂,能加快反应速率,但不能改变反应的始态和终态,不能改变乙苯平衡转化率,故B错误;
C.Fe2O3是乙苯除脱氢生成苯乙烯的催化剂,催化剂能改变反应历程,降低反应活化能,增大活化分子数和活化分子百分数,加快反应速率,故C正确;
D.Fe2O3是乙苯除脱氢生成苯乙烯的催化剂,增大接触面积,可加快反应速率,则Fe2O3颗粒大小会影响反应速率,故D错误;
故答案为:BD;
(5)原子半径:I>Br>Cl,键长:C-I>C-Br>C-Cl,键长越长,键能越小,共价键越易断裂,物质的稳定性越差,所以引发剂C6H5CH2Cl、C6H5CH2Br、C6H5CH2I中活性最高的是C6H5CH2I,
故答案为:C6H5CH2I;
(6)Cu+在配体L的水溶液中形成[Cu(L)2]+的反应为①Cu+(aq)+2L(aq)⇌[Cu(L)2]+(aq),平衡常数为K,CuBr(s)存在溶解平衡为②CuBr(s)⇌Cu+(aq)+Br-(aq),溶度积常数为Ksp,CuBr在配体L的水溶液中溶解反应为CuBr(s)+2L(aq)⇌[Cu(L)2]+(aq)+Br-(aq),①+②得到反应CuBr(s)+2L(aq)⇌[Cu(L)2]+(aq)+Br-(aq),则反应CuBr(s)+2L(aq)⇌[Cu(L)2]+(aq)+Br-(aq)的平衡常数为K•Ksp,
故答案为:K•Ksp。
故答案为:+118;
(2)反应④为C6H5C2H5(g)⇌C6H3CH=CH2(g)+H2(g),乙苯的平衡转化率为50%,则平衡时n(C6H5C2H5)=n(C6H3CH=CH2)=n(H2)=0.5mol,平衡分压p(C6H5C2H5)=p(C6H3CH=CH2)=p(H2)=$\frac{0.5mol}{0.5mol+0.5mol+0.5mol}$×100kPa=$\frac{100}{3}$kPa,该温度下的平衡常数Kp=$\frac{p(C{}_{6}H{}_{3}CH=CH{}_{2})•p(H{}_{2})}{p(C{}_{6}H{}_{5}C{}_{2}H{}_{5})}$=$\frac{100}{3}$,乙苯的平衡转化率为75%时,n(C6H5C2H5)=1mol×(1-75%)=0.25mol,n(C6H3CH=CH2)=n(H2)=0.75mol,设恒温恒压条件下充入xmol水蒸气作为稀释气,则平衡分压p(C6H5C2H5)=$\frac{0.25mol}{0.25mol+0.75mol+0.75mol+xmol}$100kPa=$\frac{25}{1.75+x}$kPa,p(C6H3CH=CH2)=p(H2)=3p(C6H5C2H5)=$\frac{75}{1.75+x}$kPa,该温度下Kp不变,即$\frac{\frac{75}{1.75+x}×\frac{75}{1.75+x}}{\frac{25}{1.75+x}}$=$\frac{100}{3}$,解得x=5,
故答案为:5;
(3)反应④的生成物H2是反应⑥进行的反应物,反应⑥生成甲苯的同时消耗H2,促进反应④生成苯乙烯的同时生成更多H2,导致反应④⑥选择性增大的同时,反应④的选择性增加更大,所以曲线b表示苯乙烯的选择性S随乙苯转化率的变化曲线,
故答案为:苯乙烯;生成苯乙烯的同时生成H2,而H2是生成甲苯的原料,所以当甲苯产率增加时,苯乙烯产量增加更多;
(4)A.X射线衍射实验是鉴别晶体与非晶体以及测定晶体结构的最可靠的途径,该技术可测定Fe2O3晶体结构,故A正确;
B.Fe2O3是乙苯除脱氢生成苯乙烯的催化剂,能加快反应速率,但不能改变反应的始态和终态,不能改变乙苯平衡转化率,故B错误;
C.Fe2O3是乙苯除脱氢生成苯乙烯的催化剂,催化剂能改变反应历程,降低反应活化能,增大活化分子数和活化分子百分数,加快反应速率,故C正确;
D.Fe2O3是乙苯除脱氢生成苯乙烯的催化剂,增大接触面积,可加快反应速率,则Fe2O3颗粒大小会影响反应速率,故D错误;
故答案为:BD;
(5)原子半径:I>Br>Cl,键长:C-I>C-Br>C-Cl,键长越长,键能越小,共价键越易断裂,物质的稳定性越差,所以引发剂C6H5CH2Cl、C6H5CH2Br、C6H5CH2I中活性最高的是C6H5CH2I,
故答案为:C6H5CH2I;
(6)Cu+在配体L的水溶液中形成[Cu(L)2]+的反应为①Cu+(aq)+2L(aq)⇌[Cu(L)2]+(aq),平衡常数为K,CuBr(s)存在溶解平衡为②CuBr(s)⇌Cu+(aq)+Br-(aq),溶度积常数为Ksp,CuBr在配体L的水溶液中溶解反应为CuBr(s)+2L(aq)⇌[Cu(L)2]+(aq)+Br-(aq),①+②得到反应CuBr(s)+2L(aq)⇌[Cu(L)2]+(aq)+Br-(aq),则反应CuBr(s)+2L(aq)⇌[Cu(L)2]+(aq)+Br-(aq)的平衡常数为K•Ksp,
故答案为:K•Ksp。