第11章 羧酸及其衍生物11-1 将下列各组化合物按酸性由强至弱排列成序。(1)D>B>A>C; (2)C>B>A>D; (3)B>A>C。知识点:羧酸的酸性。11-2 将下列各组化合物按水解反应速率由大至小排列成序。(1)A>B>D>C; (2)A>C>B。知识点:羧酸衍生物水解反应活性。水解反应是亲核加成-消除反应,连有吸电子基有利于反应进行。11-3 比较下列酸在H催化下进行酯化反应的速率。(1)>(2)>(3)>(4)知识点:酸酯化反应活性。11-4 完成下列反应。(分子内酰基化)(Claisen酯缩合反应, Wittig反应, Mannich反应)(酯与格氏试剂反应,羟醛缩合反应)知识点:羧酸及其衍生物的化学性质。11-5 给下列反应式填上适当的试剂。(1)①LiAlH,②HO; (2)Na / CHOH;(3)①LiAlH4,②H2O; (4)①HSCH2CH5SH,②H / Ni;(5)H4 / Pd-BaSO2,喹啉; (6)①LiAlH2,②H2O;(7)①NaBHH2,②H4O或Al[OCH(CH4)2] / (CH)CHOH。知识点:还原剂的选择性还原。11-6 用化学方法分离下列各组化合物,并鉴定分离出的化合物。(1)A. 2-辛醇 B. 2-辛酮 C.正辛酸(2)A. 苯酚 B. 苯甲醚 C.苯甲酸分离要求得纯化合物。A用FeCl显色鉴别,B可以根据沸点鉴别,C与NaHCO反应有气体放出。知识点:利用化学性质、物理性质分离提纯化合物。11-7 下列反应是否容易进行,并解释之。(1)容易。因为碱性:HO>Cl(2)不容易。在本条件下易发生酸碱中和反应成盐,而不易进行亲核取代反应(—NH2取代—OH)。(3)容易。OH2 的碱性大于离去基团CH3COO 的碱性。(4)容易。尽管NH-- 的亲核性比OH 强,但在碱性溶液中生成了较稳定的RCOO。因此反应趋于正反应方向。(5)不容易。因为CH2O- 的亲核性比Br- 强得多。11-8 完成下列转化。羟醛缩合反应;格氏试剂与CO反应得到多一个碳原子的酸。酮羰基官能团保护;酯与格氏试剂反应合成醇。环酮氧化,二元羧酸受热变化。仲醇氧化为酮;格氏试剂在合成中的应用;酯化反应。Reformatsky反应。羧酸及其衍生物的性质。仲醇的氧化;酮与HCN加成;腈的彻底水解;交酯的合成。羰基保护;氧化还原反应。1-17 乙醇和二甲醚,哪个焓值低?
A. 2-辛醇
B. 2-辛酮
C.正辛酸(2)
A. 苯酚
B. 苯甲醚
C.苯甲酸分离要求得纯化合物。A用FeCl显色鉴别,B可以根据沸点鉴别,C与NaHCO反应有气体放出。知识点:利用化学性质、物理性质分离提纯化合物。11-7 下列反应是否容易进行,并解释之。(1)容易。因为碱性:HO>Cl(2)不容易。在本条件下易发生酸碱中和反应成盐,而不易进行亲核取代反应(—NH2取代—OH)。(3)容易。OH2 的碱性大于离去基团CH3COO 的碱性。(4)容易。尽管NH-- 的亲核性比OH 强,但在碱性溶液中生成了较稳定的RCOO。因此反应趋于正反应方向。(5)不容易。因为CH2O- 的亲核性比Br- 强得多。11-8 完成下列转化。羟醛缩合反应;格氏试剂与CO反应得到多一个碳原子的酸。酮羰基官能团保护;酯与格氏试剂反应合成醇。环酮氧化,二元羧酸受热变化。仲醇氧化为酮;格氏试剂在合成中的应用;酯化反应。Reformatsky反应。羧酸及其衍生物的性质。仲醇的氧化;酮与HCN加成;腈的彻底水解;交酯的合成。羰基保护;氧化还原反应。1-17 乙醇和二甲醚,哪个焓值低?
题目解答
答案
答:乙醇的焓值≈5C—H+C—C+C—O+O—H=5×414.2+347.3+359.8+464.4=3242.5 kJ.mol-1
二甲醚的焓值≈6C—H+2C—O =6×414.2+2×359.8=3204.8 kJ.mol-1
所以,二甲醚的焓值稍低。
1-18 下列物质是否含有共轭酸和共轭碱?如有,请分别写出。
答:(1)即有共轭酸也有共轭碱,共轭酸是CHNH,共轭碱是CHNH;
(2)共轭酸是CH3OH;
(3)即有共轭酸也有共轭碱,共轭酸是CH3CHOH,共轭碱是CHCHO;
(4)共轭酸是H3;
(5)共轭酸是CH2;
(6)共轭碱酸是CH4CH,共轭碱是CH=CH。
1-19 将下列物种按碱性,由强至弱排列成序。
答:参照书中表1-9排出,CHCH>HN>HC≡C>CHO>OH。
11-9 用乙酰乙酸乙酯或丙二酸二乙酯为原料,合成下列化合物(其它试剂任选)。
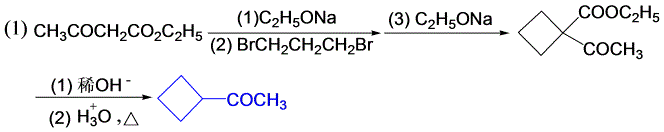
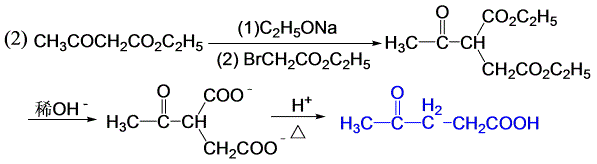
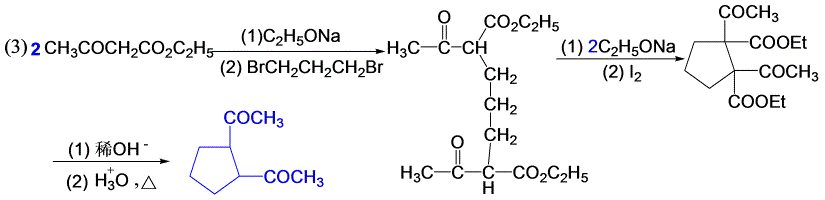
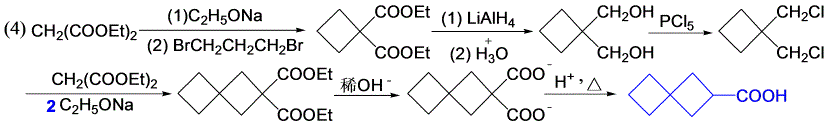
乙酰乙酸乙酯、丙二酸的性质。
11-10 设计以环已烷为起始原料合成尼龙-6的合成路线,并指出各步反应的类型。
反应类型:①自由基取代反应,②亲核取代反应,③氧化反应,④亲核加成-消除反应,⑤Beckmann反应,⑥开环聚合反应。
尼龙-6的合成;常见反应类型的识别。
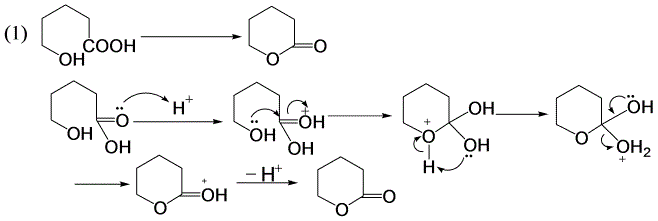
11-11 对下列反应提出合理的机理,并用弯箭头表示电子转移过程。
酸催化下酯化反应机理。
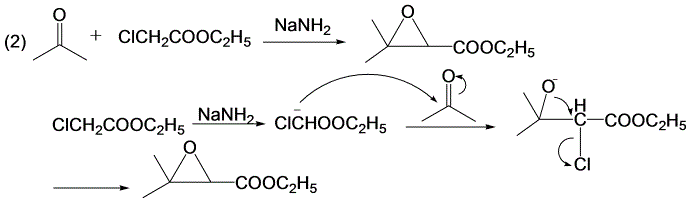
Darzens反应机理(亲核加成,分子内亲核取代)。
酯交换反应;分子内亲核取代反应。
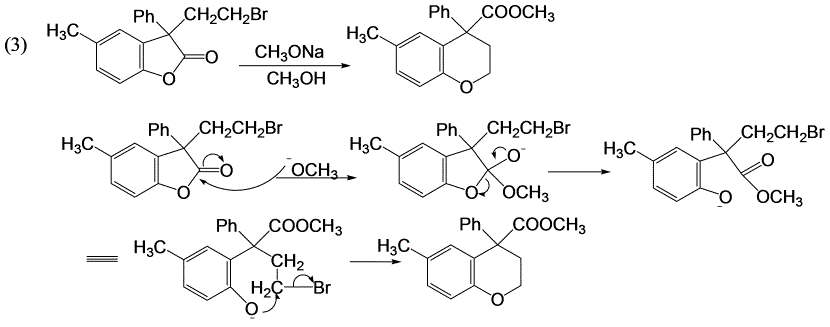
Claisen酯缩合反应及其逆反应机理。
11-12 推断A ~D的构造式,并写出各步反应式。
羧酸及其衍生物之间的互变。
11-13 写出A,B的构造式。
羧酸、酚、酯的性质。
11-14推测A ~ F的构造式。
Reformasky反应; Wittig反应;羟醛缩合反应;H NMR,IR,UV,MS谱。
11-15推测A ~ F的构造式。
缩醛的性质;碘仿反应。
11-16 请讨论羧酸及其衍生物和亲核试剂的反应与醛酮和亲核试剂的反应有何差异?为什么会有这种差异?
提示:①羧酸及其衍生物与亲核试剂反应的结果是亲核取代反应的产物;
②羧酸及其衍生物亲核取代反应的机理是先加成,再消除;
③醛酮与亲核试剂反应是亲核加成;
④产生差异的原因:羧酸及其衍生物中Y是较好的离去基团,而R(H)亲核性强,不是好的离去基团。
11-17 比较CHF、HOCHCHCl、CHCHOH、CHCOOH分子间形成氢键的差别
11-18 比较并解释RCl和RCOCl与亲核试剂Nu2 反应的机理及反应活性差异。
提示:①相同点是反应结果都是Nu取代Cl,生成相应的RNu和RCONu。
②RCl与Nu-反应机理是S1或S2;
③RCOCl与亲核试剂Nu- 反应的机理是先亲核加成生成一个四面体型的中间体(其中C为sp-杂化),再消去Cl生成RCONu。