题目
下列电池:Pt,H2(p?)|H2SO4(aq)|O2(p?),Pt298K时E=1.228V,已知液体水的生成热ΔfHm? (298K,H2O,l) = -2.851×105J·mol-1。(1) 写出电极反应和电池反应;(2) 计算此电池电动势的温度系数;(3) 假定273K~298K之间此反应的ΔrHm为一常数,计算电池在273K时的电动势。
下列电池:Pt,H2(p?)|H2SO4(aq)|O2(p?),Pt
298K时E=1.228V,已知液体水的生成热ΔfHm? (298K,H2O,l) = -2.851×105J·mol-1。
(1) 写出电极反应和电池反应;
(2) 计算此电池电动势的温度系数;
(3) 假定273K~298K之间此反应的ΔrHm为一常数,计算电池在273K时的电动势。
题目解答
答案
解:
(1) (-) H2→2H++2e
(+)1/2O2+2H++2e→H2O(l)
电池反应:H2(g)+1/2O2(g)→H2O(l)
(2) ΔrGm=-nFE=-2×96500×1.228=-2.37×105 (J·mol-1)
根据 ΔrHm==-Nfe+nFT(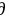 E/
E/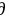 T)p
T)p
-2.861×105=-2.37×105+2×96500×298×(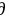 E/
E/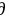 T)p
T)p
(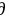 E/
E/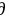 T)p =-8.537×10-4 (V·K-1)
T)p =-8.537×10-4 (V·K-1)
(3) 根据 ΔrHm=nF[E-T(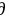 E/
E/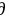 T)p]; 得 E=1.25(V)
T)p]; 得 E=1.25(V)
解析
步骤 1:写出电极反应和电池反应
在电池中,氢气在负极被氧化,氧气在正极被还原。根据这些信息,我们可以写出电极反应和电池反应。
步骤 2:计算电池电动势的温度系数
根据热力学关系,我们可以计算电池电动势的温度系数。这需要使用电池电动势、反应的吉布斯自由能变化和反应的焓变。
步骤 3:计算电池在273K时的电动势
根据电池电动势的温度系数和反应的焓变,我们可以计算电池在273K时的电动势。
在电池中,氢气在负极被氧化,氧气在正极被还原。根据这些信息,我们可以写出电极反应和电池反应。
步骤 2:计算电池电动势的温度系数
根据热力学关系,我们可以计算电池电动势的温度系数。这需要使用电池电动势、反应的吉布斯自由能变化和反应的焓变。
步骤 3:计算电池在273K时的电动势
根据电池电动势的温度系数和反应的焓变,我们可以计算电池在273K时的电动势。